【J. Org. Chem.】华侨大学崔秀灵课题组:光催化分子内的[2+2]环加成/去芳构化反应合成半饱和杂环化合物
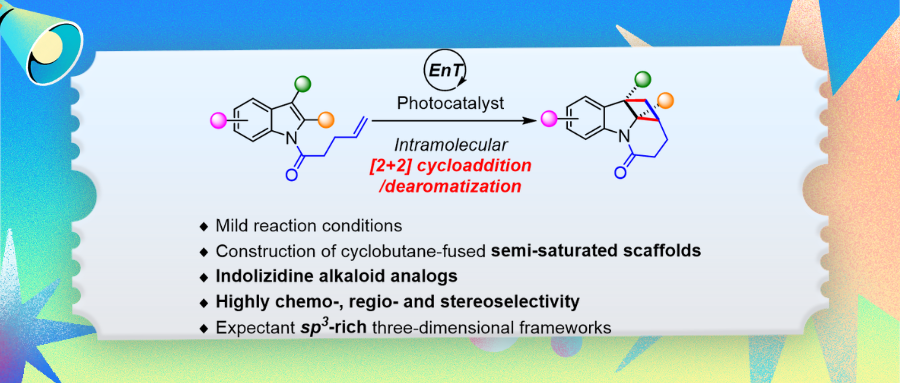
增加含有芳环的有机药物分子中sp3碳的比例(Fsp3)在新兴药物的发现和设计领域备受关注。因此,美国密西根大学的Tim Cernak课题组、上海交通大学的马佳佳课题组和德国明斯特大学的Frank Glorius课题组共同发展了药物研发新策略——后期饱和化(late-stage saturation,LSS,J. Am. Chem. Soc. 2024, 146, 11866-11875),即通过去芳构化反应来修饰和编辑芳环,进而得到对应的(半)饱和功能化骨架,并合成了一系列有趣的结构。其中,分子内[2+2]环加成/去芳构化反应是构建半饱和稠环化合物的理想方法之一。然而,由于环丁烷的不稳定性和底物较高的三重态激发能垒,这种反应被认为是热力学上不可行的。最近,华侨大学崔秀灵课题组报道了光催化吲哚和非活化烯烃的分子内[2+2]环加成,成功得到了一系列半饱和杂环化合物和生物碱类似物——环丁烷并吲哚里西啶(图1)。相关成果发表在The Journal of Organic Chemistry上(DOI: 10.1021/acs.joc.5c01294)。
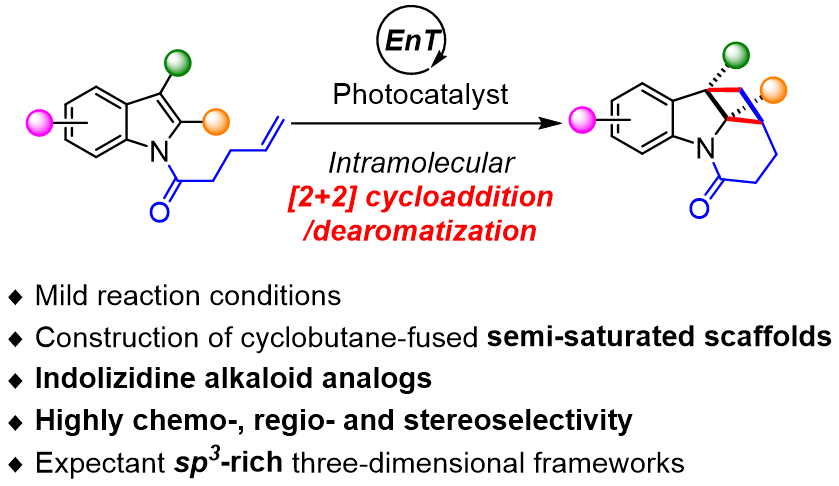
图1 可见光介导的吲哚与非活化烯烃的分子内[2+2]环加成/去芳构化反应(来源:J. Org. Chem.)
关于半饱和杂环化合物的构筑,已经开发了环加成反应、自由基介导或过渡金属催化的级联环化反应和C-H键功能化环化反应,还原反应等策略。其中,华侨大学崔秀灵课题组长期致力于开发和构建有价值的小分子半饱和骨架,已经通过C-H键功能化和自由基环化等策略已经合成了功能化的二氢异喹啉、四氢喹喔啉、吲唑、螺咪唑-茚环、螺恶嗪-吡喃、螺吲哚-吡唑、3-羟吲哚和苯二氮卓等半饱和杂环结构(Org. Lett. 2020, 22, 6484-6488; Org. Lett. 2020, 22, 6272-6276; Org. Chem. Front. 2022, 9, 5617-5623; Adv. Synth. Catal. 2023, 365, 1817-1823; New J. Chem. 2023, 47, 14430-14435; Org. Chem. Front. 2024, 11, 1811-1816; Green Synth. Catal. 2024, 5, 31-34; Nat. Commun. 2024, 15, 6183; Org. Biomol. Chem. 2025, 23, 4966-4970; Green Synth. Catal. 2025, 6, 75-80; Org. Lett. 2025, 27, 3495-3500)。之后,崔秀灵课题组在之前开发的光催化反应的基础上(Org. Biomol. Chem. 2022, 20, 5779-5783; Org. Chem. Front. 2022, 9, 364-369; Chin. J. Org. Chem. 2025, 45, 686-693; J. Org. Chem. 2025, 90, 10386-10391),为了深入理解和践行“后期饱和化”这一理念,于2025年先后报道了吲哚与活化和非活化烯烃的分子间和分子内[2 + 2]环加成/去芳构化反应(图2,a:分子间{Org. Chem. Front. 2025, 12, 3177-3183};b:分子内{J. Org. Chem. 2025, DOI: 10.1021/acs.joc.5c01294}),在实现药物特权结构吲哚的(半)饱和化的同时得到了刚性的四元环并吲哚啉和吲哚里西啶结构。
图2 光催化吲哚的分子间和分子内[2 + 2]环加成反应(来源:J. Org. Chem.)
在该研究中(图2,b),作者利用简单的亲核取代反应一步得到N-烯烃功能化吲哚1,随后对不同光催化剂、溶剂、反应时间等条件进行系统考察。筛选出该反应的优化条件为:0.2 mmol的底物1a和5 mol% 的噻吨酮(TXT)溶解于4 mL三氟乙醇中,在氮气条件下光照并搅拌反应18小时,收率为98%。在确定优化后的反应条件后,探讨了各种吲哚的范围和通用性,如图3所示。首先考察吲哚的C5和C6位取代基,含卤素(F、Cl和Br)和供电子基团(Me)的底物反应效果较好,以中等至良好的产率提供相应的产物2b-2h。由于C2位芳基存在的必要性,研究了C2-芳基上的取代基。非活化烯烃功能化的2-(4-卤苯基)-1H-吲哚底物以中等的产率得到对应的半饱和稠环化合物2i-2k。烷基取代的2-芳基吲哚的产率最高达到80%(2l-2o)。接下来,考察了C2和C3双取代杂环的反应效果,以验证该策略的可用性(1p-1y)。当使用2-芳基-3-甲基吲哚作为底物时,[2 + 2]环加成的反应效果在大多数情况下(2p-2y)有所提高,以高达85%的产率获得预期的大位阻张力环。如果这些含有甲基的分子可以作为候选药物,在“magic methyl effect”的指导下可能会改善其药理特性。此外,还研究了其他吲哚的分子内[2+2]环加成,如2-酯基、2,3-二甲基和3-甲基,它们也可以进行[2+2]环加成从而实现吲哚的后期饱和化。而含吲哚药物分子的后期饱和化在合成复杂的生物活性分子骨架方面具有巨大的潜力。在该研究中尝试修饰褪黑素和色氨酸衍生物,这些生物活性分子以良好的产率得到了相应的半饱和稠环结构。

图3 底物普适性考察(来源:J. Org. Chem.)
在系统考察底物普适性后,作者对该反应的机理进行了推测(图4)。首先,TXT(S0)被可见光激发,并发生Dexter能量转移,促使底物1转化为其对应的双自由基三线态中间体1*。两个单电子分布在吲哚的C2和C3号位。C2-苯基的存在可能会稳定2号位的自由基。因此,过渡态TS将优先通过“tail-to-tail”的形式偶联,进而得到1,4-双自由基中间体INT1,然后INT1经历系间窜越(ISC)得到单线态中间体INT2。最后,通过自由基-自由基偶联得到高化学、区域和立体选择性的半饱和杂环化合物2。
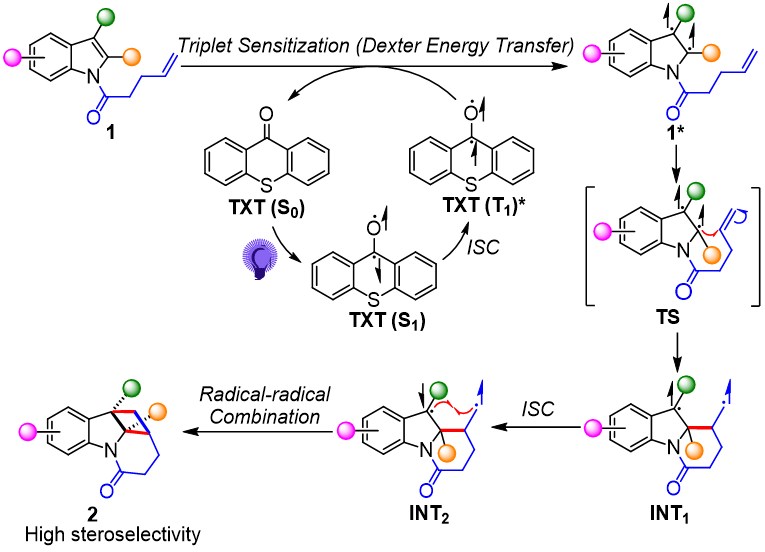
图4 机理研究(来源:J. Org. Chem.)
综上所述,作者开发了一种实用且低成本的策略,来实现光催化吲哚和非活化烯烃的分子内[2+2]环加成/脱芳构化。在环境友好和温和的反应条件下,得到了一系列半饱和生物碱类似物——环丁烷并吲哚里西啶。具有优异的化学选择性、区域选择性和立体选择性(> 99:1 dr)。该方法也成功应用于吲哚药物分子的后期饱和化。华侨大学医学院崔秀灵教授为该论文的通讯作者,硕士研究生韩增为论文第一作者,本科生王佳茵和张红老师参与了部分工作。这项工作得到了福建省(3502ZCQXT2021006)、111项目(BC2018061)和华侨大学先进碳转化技术研究院开放研究基金(AACCT0007)的支持。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




