【JACS】美国科学院院士Gregory C. Fu:光诱导铜催化烷基卤化物的对映汇聚叠氮化反应
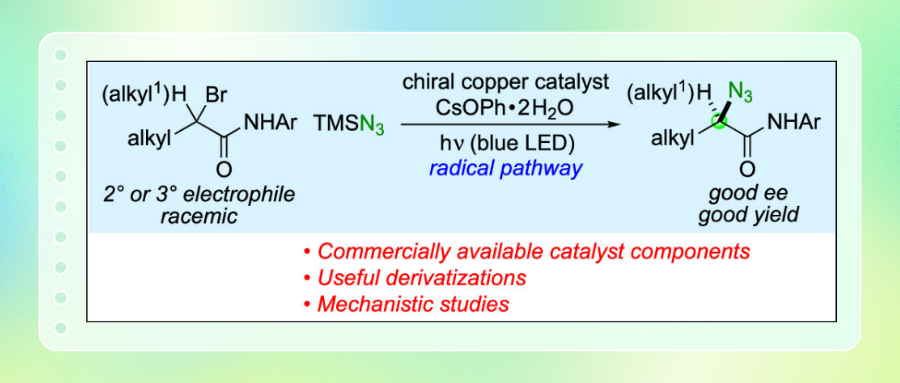
烷基卤的叠氮亲核取代反应是有机叠氮化合物合成中应用最广泛的方法,但目前仅有两种该经典反应对映选择性变体的报道。近日,加州理工学院美国科学院院士Gregory C. Fu教授报道光诱导手性铜催化剂(由市售原料原位生成)可实现外消旋仲烷与叔烷基卤化物的对映汇聚式叠氮化反应。所得高对映选择性的烷基叠氮化合物既是重要的合成终点产物,也可作为合成砌块。机理研究为催化循环中关键中间体的存在提供了实验证据。相关成果发布于期刊J. Am. Chem. Soc.
手性烷基叠氮化合物在有机合成、药物化学、生物化学及生物学等诸多科学领域兼具终端产物与选择性反应试剂的双重重要功能。目前已有多种催化不对称合成烷基叠氮化合物的方法被报道。相比之下,尽管烷基卤化物的叠氮亲核取代是合成烷基叠氮化合物的经典方法,但据作者所知,该过程的不对称催化迄今仅有两篇报道。合成高对映选择性的α-叠氮羰基化合物具有特殊重要意义(Figure 1A)。本文中,作者首次使用市售DTBM-SEGPHOS(L)作为手性配体,光诱导手性铜催化剂实现普通α-卤代羰基化合物(包括仲位和叔位)与叠氮试剂的对映汇聚取代反应(Figure 1C)。此外,作者通过机理研究阐明该新反应过程可能涉及铜(I)-叠氮复合物、铜(II)-叠氮复合物以及有机自由基等关键中间体。
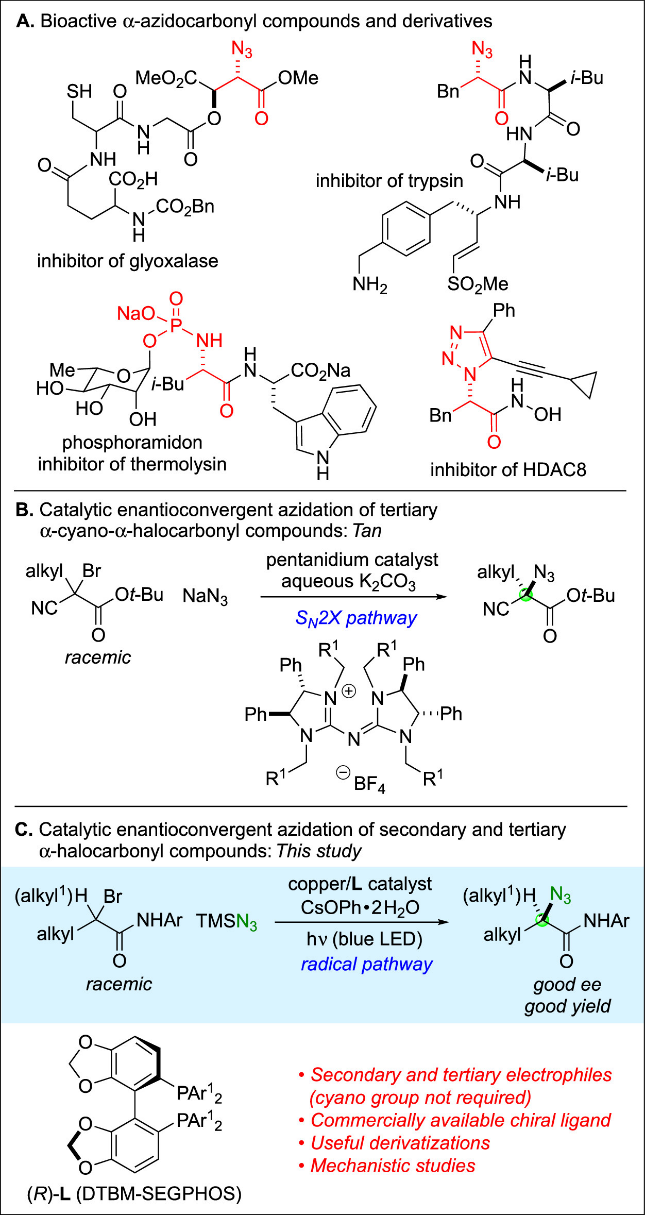
Figure 1. Enantioenriched α-azidocarbonyl compounds.
(来源:J. Am. Chem. Soc.)
鉴于仲位α-卤代羰基化合物的对映汇聚叠氮化反应尚无先例,作者首先聚焦于攻克这一挑战。以外消旋α-异丙基-α-溴代酰胺为模型底物进行研究,作者发现在[Cu(CH3CN)4]PF6/L催化剂体系和光照条件下,采用TMSN3/CsOPh·2H2O作为叠氮源进行反应,可获得优异对映选择性和极高产率(94% ee,产率96%;Figure 2,entry 1)。克级规模实验仍保持优异对映选择性和良好产率。
作者发现上述优化条件可适用于一系列外消旋仲位α-溴代酰胺的对映汇聚叠氮化反应(Figure 2)。当α-烷基取代基(R)为仲烷基(环状或无环)时,该方法始终呈现优异立体选择性和产率(entry 1-11)。反应立体化学由催化剂而非底物相邻(β位)手性中心控制(entry 10和11)。当α-烷基取代基(R)为伯烷基(entry 12-18)甚至大位阻叔烷基(entry 19和20)时,催化对映汇聚叠氮化仍能实现良好对映选择性和产率。当R为苯基而非烷基时,在未进一步优化条件下,标准反应仍能以62% ee和94%产率实现对映汇聚叠氮化。作者还系统研究了酰胺N-芳基(Figure 2中Ar)的适用范围:芳环含给电子或吸电子取代基时,不对称叠氮化反应均能获得良好对映选择性和产率(entry 21和22);邻位取代(entry 23)、扩展芳环及杂芳环体系(entry 24和25)均可兼容。
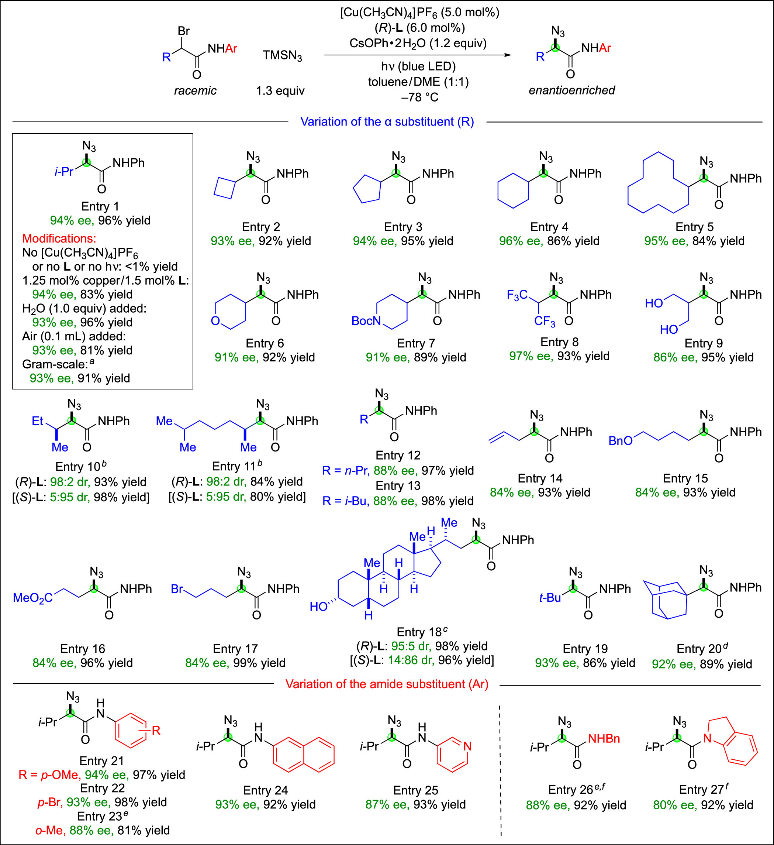
Figure 2. Enantioconvergent azidations of racemic secondary α-bromoamides.(来源:J. Am. Chem. Soc.)
不仅仲位烷基卤(Figure 2),叔位烷基卤(Figure 3)在这些标准条件下也能实现光诱导对映汇聚叠氮化反应。这表明手性铜催化剂能有效区分α位的两个烷基,以良好对映选择性制备叔烷基叠氮化合物。
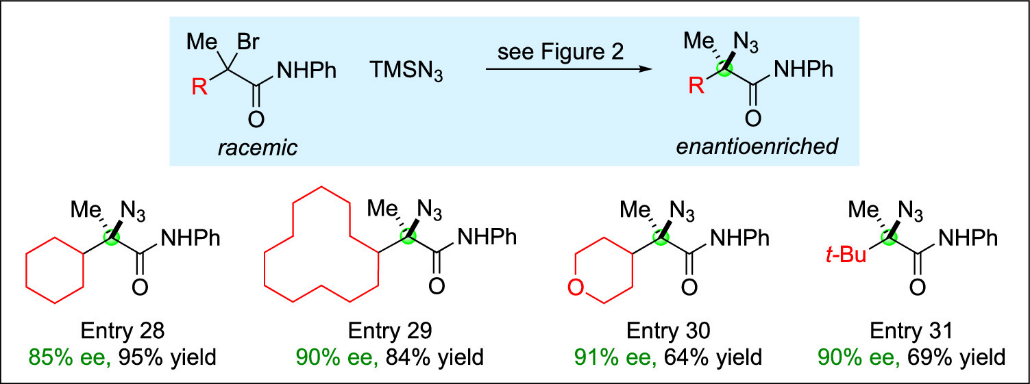
Figure 3. Enantioconvergent azidations of racemic tertiary α-bromoamides.(来源:J. Am. Chem. Soc.)
高对映选择性的α-叠氮羰基化合物不仅是重要的终端产物,更是不对称合成中的多功能中间体(Figure 4)。它们可在不发生消旋化的前提下,以良好产率转化为多种化合物,包括胺类(a)、磷酰胺酯(b)、三氮唑(c和d)以及四氮唑(e)。
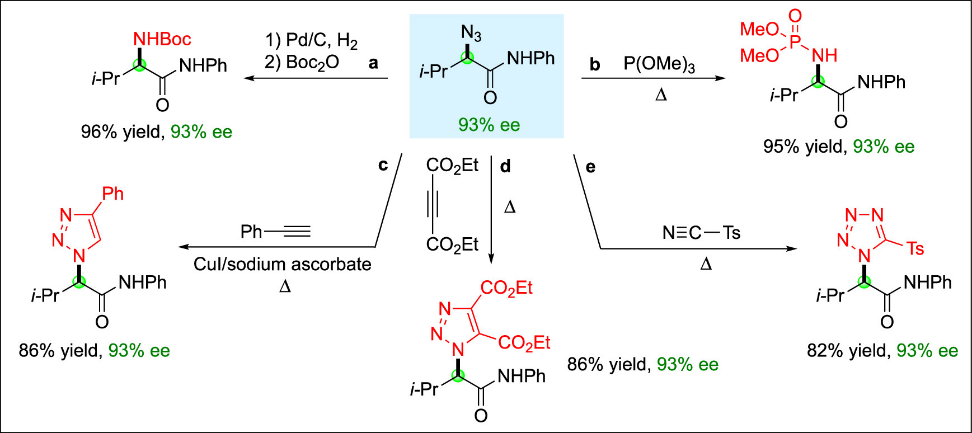
Figure 4. Transformation of an enantioenriched alkyl azide into other useful families of enantioenriched compounds.(来源:J. Am. Chem. Soc.)
随后,作者研究了这种新型光诱导铜催化对映汇聚叠氮化烷基溴反应的潜在机理(Figure 5A)。第一步:LCuI(N3) (A)在光照下产生激发态配合物[LCuI(N3)]* (B);第二步:该激发态与烷基溴发生电子转移,生成烷基自由基C和铜(II)配合物LCuII(N3)Br (D);第三步:D与CsN3发生配体置换生成LCuII(N3)2 (E),随后与烷基自由基C反应生成高对映选择性烷基叠氮产物,同时再生A。作者已证实CsOPh·2H2O在甲苯/DME溶液中与TMSN3定量反应生成CsN3(Figure 5A底部)。机理研究采用亲电试剂1作为底物(Figure 5A)。
作者独立合成并通过晶体学表征了LCuI(N3) (A),其在固态呈二聚体结构。光照前溶液中主要铜/膦物种为A(Figure 5B)。使用该预催化剂替代[Cu(CH3CN)4]PF6/L进行亲电试剂1的对映汇聚叠氮化,可获得完全相同的对映选择性与产率(94% ee,96% 产率)。A激发态的发光可被亲电试剂1猝灭(Figure 5C)。激发态[LCuI(N3)]* (B)的寿命为0.66 μs。EPR光谱研究揭示了反应过程中存在的铜(II)物种(Figure 5D),作者初步指认为LCuII(N3)2 (E)。DFT计算为该指认提供了进一步支持。
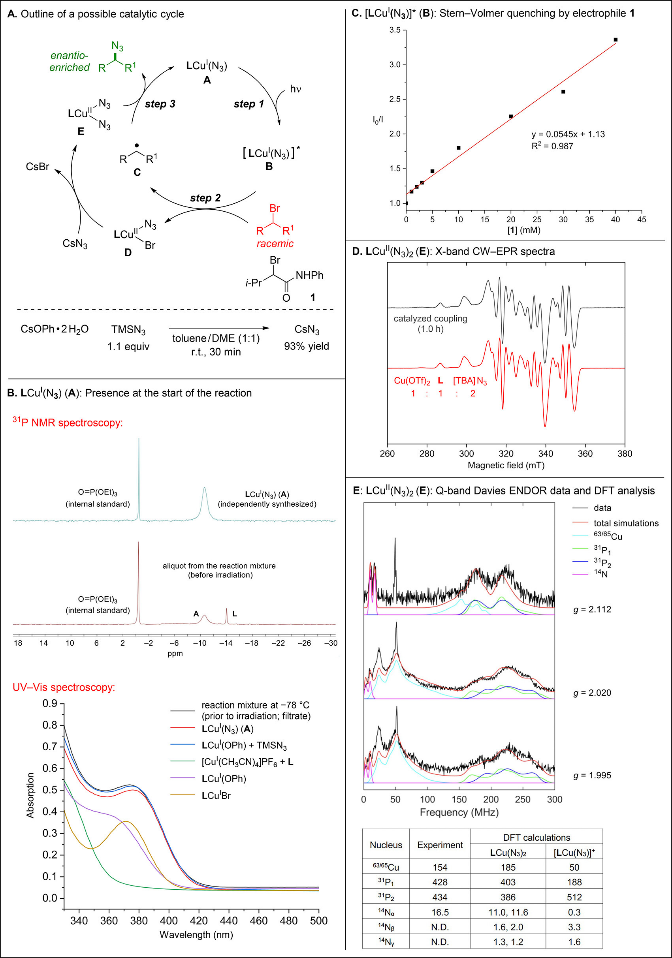
Figure 5. Mechanistic studies, including possible support for proposed intermediates.(来源:J. Am. Chem. Soc.)
标准条件下,亲电试剂1在整个反应过程中始终保持外消旋状态(<5% ee),未发现显著动力学拆分或去消旋化证据。此外,高对映纯度(R)-1(98% ee)在(S)-L或(R)-L存在下进行叠氮化时,ee值损失极小(转化率>85%时ee≥90%),表明C-Br键断裂步骤在此条件下基本不可逆。在标准反应条件下,烷基碘F发生环化/叠氮化反应的对映选择性(93% ee)与Figure 2, entry 3结果(94% ee)基本一致,表明这两类不对称叠氮化反应存在共同中间体C1(Figure 6A)。当向标准对映汇聚叠氮化体系加入TEMPO时,反应生成亲电试剂的TEMPO加合物而非烷基叠氮化物(Figure 6B)。至此,所有机理研究结果均与Figure 5A所示路径相符——铜(I)/铜(II)-叠氮复合物及有机自由基作为关键中间体参与催化循环。
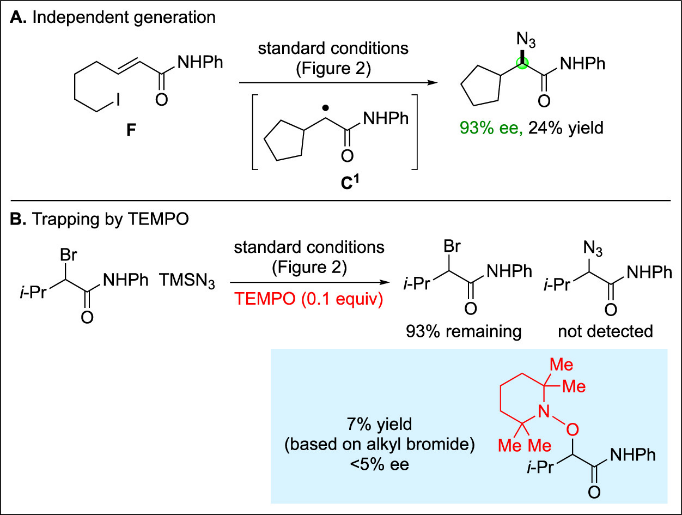
Figure 6. Mechanistic studies: Support for organic radical C.
(来源:J. Am. Chem. Soc.)
烷基卤化物的叠氮亲核取代是合成有机化学中的经典转化,其催化对映选择性变体长期难以实现。这篇工作发现光诱导手性铜催化剂能实现一系列外消旋仲/叔烷基卤化物的对映汇聚叠氮化,成为该领域迄今报道通用性最强的催化体系。所得高对映选择性烷基叠氮化合物不仅是重要的终端产物,更能转化为其他关键手性化合物类别。机理层面,作者为以铜-叠氮复合物和有机自由基为核心的反应路径提供了实验证据。目前正致力于通过光诱导铜催化策略解决不对称合成领域的其他重要挑战。
论文信息:
Photoinduced, Copper-Catalyzed Enantioconvergent Azidation of Alkyl Halides
Feng Zhong, Robert L. Anderson, Paul H. Oyala, and Gregory C. Fu*
J. Am. Chem. Soc. 2025




