【OL】中南大学阳华/陈凯课题组:镍/光氧化还原双催化下通过协同烷基与苯甲酰自由基偶联实现烯烃的区域选择性1,2-碳酰化
相比经典的光氧化还原/镍协同催化的烯烃双官能化研究,通过直接自由基-自由基偶联的策略实现烯烃双官能化仍然有待探索。该策略可以避免对常规C(sp2)-杂化亲电试剂的依赖,并为多样化分子结构的模块化构建提供可能。近期研究表明,烷基溴化物可在镍/光氧化还原协同催化体系中被低价镍物种活化生成烷基自由基,进而参与后续反应。由此可推断,烷基溴化物可作为有效的亲电试剂,与光催化剂通过单电子氧化活化的亲核试剂协同作用,实现烯烃的双官能化。2023年,袁伟明团队报道了一种正交的镍介导烷基卤化物的还原与光氧化还原驱动的α-硅基胺氧化相结合的策略,实现了烯烃的化学与区域选择性双烷基化。基于这一策略的成功以及阳华教授课题组对协同催化体系持续的深入研究,该团队成功通过利用协同催化体系,即镍介导的烷基自由基生成与光氧化还原引发的苯甲酰自由基形成结合,绕过了经典的氧化加成途径,实现了烯烃的区域选择性1,2-碳酰化,成功在烯烃上同时构建了C(sp2)-C(sp3)键和C(sp3)-C(sp3)键。
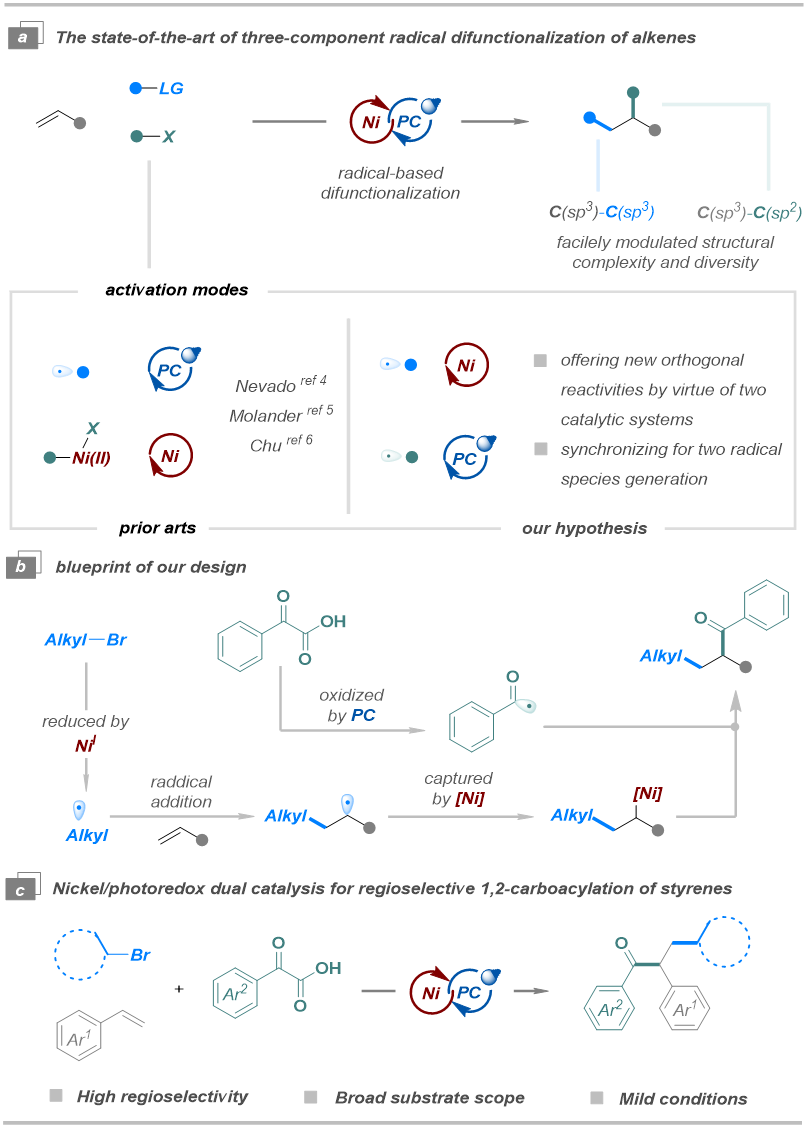
图1.研究背景及本课题的设计思路(来源:Organic Letters)
首先,作者以4-甲氧基苯乙烯(1a)、4-溴四氢吡喃(2a)以及4-甲氧基苯甲酰甲酸(3a)作为模型反应底物进行了反应条件的筛选,最终使用2 mol%的4-CzIPN作为光催化剂,10 mol%的Ni(OTf)2作为镍催化剂,12 mol%的双[(S)-4-异丙基-4,5-二氢噁唑-2-基]甲烷为配体,Cs2CO3(2.25当量)作碱,甲醇为溶剂,氩气保护,30~35℃及40W 456 nm蓝光照射下,48小时后以85%的产率获得了目标化合物4。
在最优条件下,作者对烷基溴代物的官能团耐受性进行了考察(图2)。研究结果发现,诸如环丙烷、环丁烯和氧杂环丁烷溴化物等张力环体系表现良好,产此外,其他饱和的五至七元碳环和杂环化合物也展现出良好适用性。值得注意的是,异丙基溴和3-戊基溴等无环仲烷基溴化物同样能实现转化。异丁基(16)和异苯基丁基溴化物(17)虽表现出较差的非对映选择性(dr 1:1至1.3:1),但仍能以中等产率获得相应产物。随后研究表明,带有苯基、苯氧基、叔丁基二甲基硅氧基、氰基、酯基等多种官能团的伯烷基溴化物,以及远端带有L-薄荷醇片段的底物均可顺利参与反应,这为后续合成衍生化提供了平台。值得关注的是,α-支链烷基溴化物同样可作有效底物。此外,尽管产率较低,具有空间位阻的叔丁基溴也能转化为相应产物。
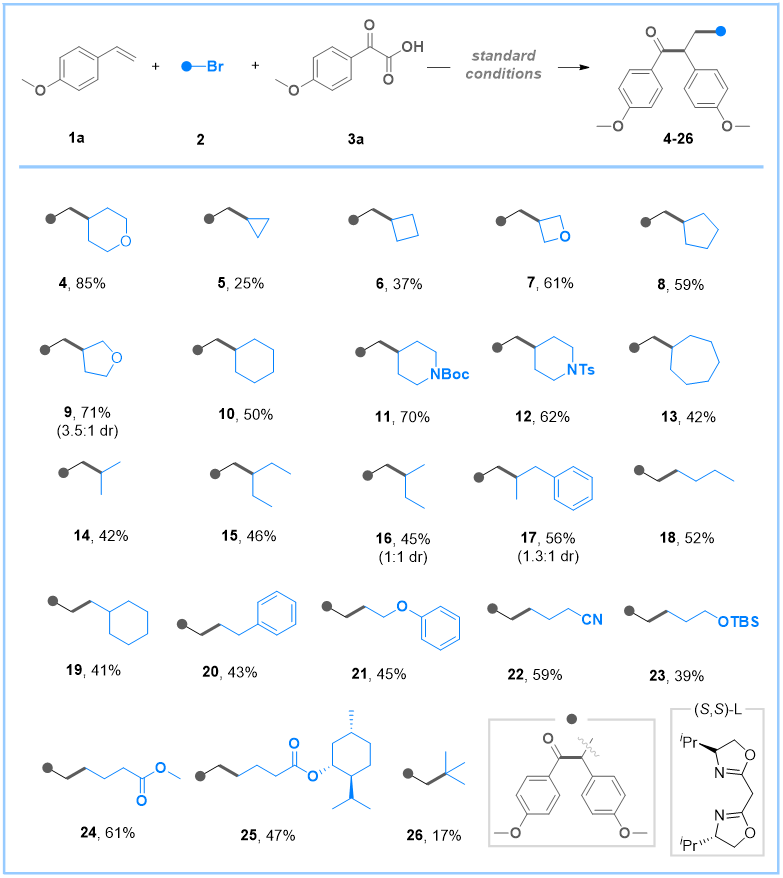
图2. 烷基溴的底物范围(来源:Organic Letters)
随后,作者在标准条件下对烯烃的底物范围进行了探索(图3)。研究发现,在苯乙烯底物苯环对位引入电子中性取代基进行反应时,均能以中等至良好产率顺利生成预期的1,2-碳酰化产物。需要指出的是,产物30收率偏低可能与其对应烯烃底物在反应体系中的溶解性较差有关。而当苯环对位引入吸电子基团时,反应效率均出现不同程度下降。此外,苯环间位取代的苯乙烯同样表现出良好的反应活性。而邻位吸电子取代基对反应进程存在显著抑制效应。与此同时,多取代苯乙烯底物也展现出较好的适用性,并且该反应体系还可兼容1,2-二取代烯烃底物。以L-薄荷醇和果糖二丙酮为原料制备的芳基烯烃均成功应用于该方法,顺利获得目标产物,展现了该方法的实用性。此外,1,3-二烯也被证明是该反应的有效底物,能以27%收率获得区域选择性优异(r.r. > 9:1)的对应产物。然而,1,1-二取代苯乙烯、杂芳基烯烃、丙烯酸酯及其他非活化烯烃在该体系中均未能有效反应。
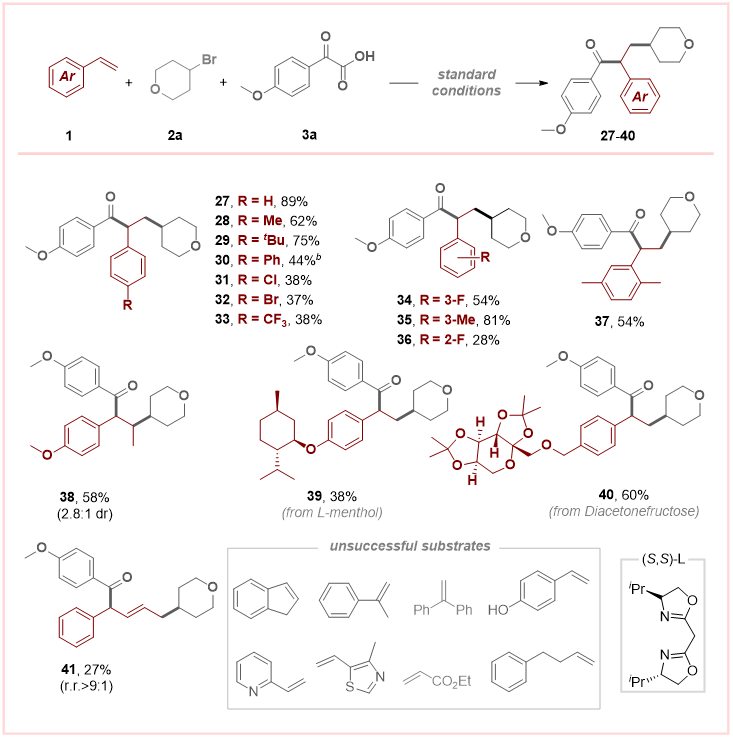
图3. 烯烃的范围(来源:Organic Letters)
此外,作者在标准条件下对酮酸的底物范围进行了探索(图4)。当苯环对位带有电子中性基团或吸电子基团的α-氧代羧酸能够顺利生成相应的1,2-羰基酰化产物,产率中等。苯环间位带有-CF3取代基的芳香族α-酮酸产率相对较低。邻位甲基取代的底物也能顺利反应得到对应产物。而芳环上含多取代基的底物显示出良好的反应性,产率良好。然而,使用杂环或脂肪族α-氧代羧酸时未观察到反应发生。
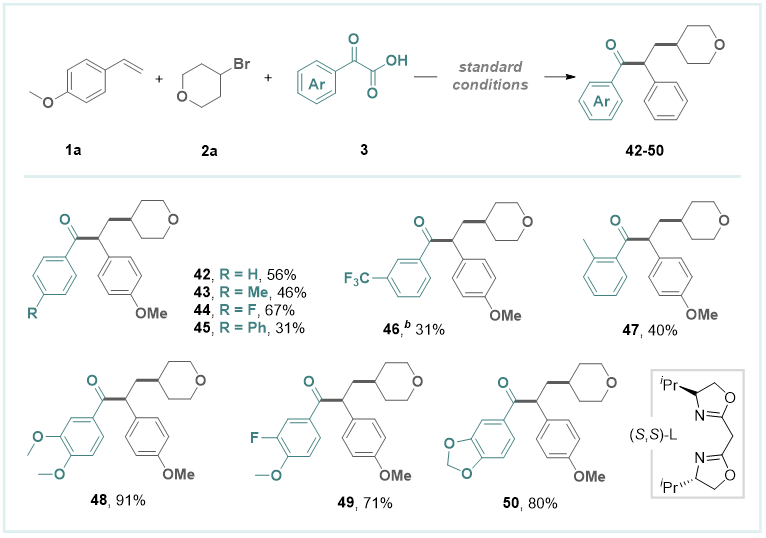
图4. 酮酸的范围(来源:Organic Letters)
为进一步验证该合成方法的实用价值,作者开展了放大实验(以底物2a的2 mmol规模进行反应),以80%的产率成功制备化合物4。随后对化合物4开展衍生化研究。作者首先采用硼氢化钠(NaBH4)对4进行选择性酮基还原,以88%的产率获得醇类产物;随后通过经典的Wittig反应实现烯基化修饰,得到对应产物,产率达74%(图5)。
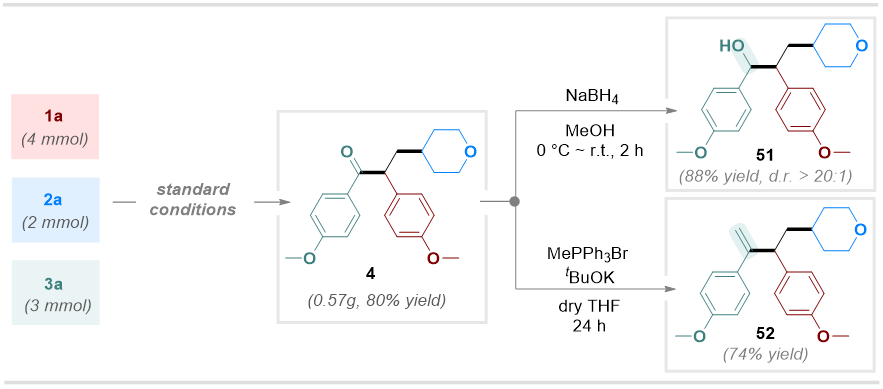
图5. 反应应用研究(来源:Organic Letters)
为了进一步探究反应机理,作者开展了一系列控制实验(图6)。首先,作者进行了自由基捕获实验。向体系中添加TEMPO能完全抑制反应进程,同时通过ESI-HRMS分析初步检测到三个对应的自由基加合物。随后开展的自由基探针实验中,成功分离得到预期环化偶联产物。这些结果表明该反应过程涉及自由基路径。随后,作者进一步通过一级溴代烷与二级溴代烷的竞争实验发现,卤代烷的反应活性顺序与对应烷基自由基的稳定性一致,这表明烷基自由基的生成应是该转化过程的限速步骤。此外,Stern-Volmer实验表明,相较于其他反应组分,[3a+Cs2CO3]对4-CzIPN激发态的还原淬灭效率更高。同时,光开关实验基本排除了自由基链增长途径的可能性。
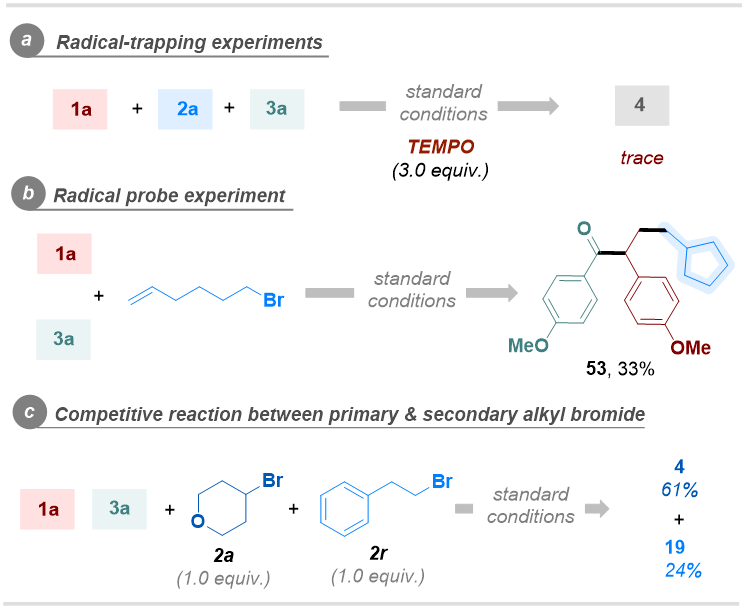
图6. 机理研究(来源:Organic Letters)
基于以上实验结果和先前的报道,作者提出了可能的反应机理(图7)。首先,α-酮酸在碱性条件下发生去质子化,形成阴离子中间体A,其直接受到光激发态4-CzIPN的氧化作用生成氧中心自由基B。随后自由基B经历脱羧反应并释放CO2,生成苯甲酰自由基C。另一方面,Ni(I)物种I通过卤素原子转移(XAT)活化烷基溴化物,生成烷基自由基D和Ni(II)物种II。接着,烷基自由基D对烯烃的加成作用形成稳定的苄基自由基E,该自由基被Ni(II)物种II捕获生成Ni(III)物种III。继而,中间体III被4-CzIPN•-还原为Ni(II)中间体IV,随后其捕获苯甲酰自由基C生成Ni(III)物种V。最终,Ni(III)物种V通过还原消除得到目标产物,同时再生Ni(I)催化剂I。
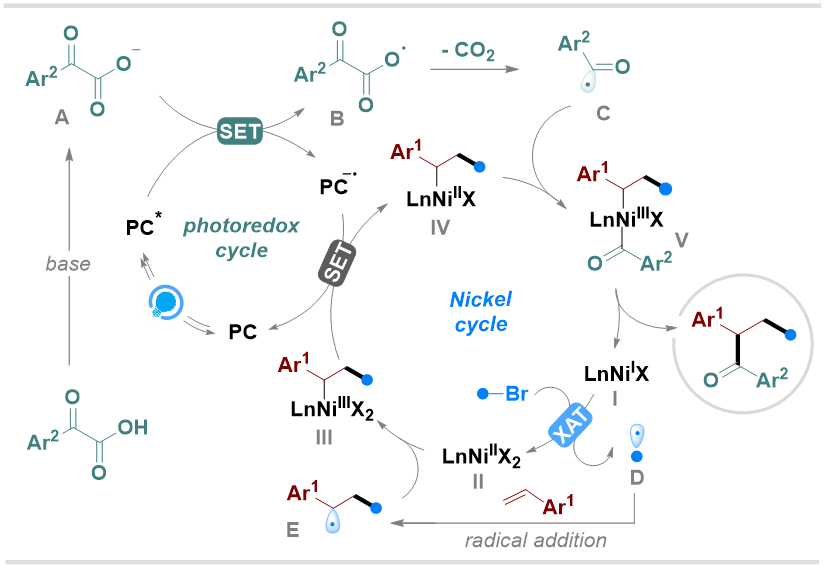
图7. 可能的反应机理(来源:Organic Letters)
总之,阳华教授课题组开发了一种开发了一种通过镍/光氧化还原双催化实现的烯烃区域选择性三组分1,2-碳酰化的新策略。该策略有望激发更多关于双催化体系中自由基对协同作用的机理研究,从而拓展烯烃双官能团化和多样化转化的化学空间。
该工作近期发表在Organic Letters,中南大学化学化工学院阳华教授和陈凯副教授为论文共同通讯作者,论文第一作者是中南大学2022级博士研究生何显臣同学。(论文作者:Xian-Chen He, Jie Gao, Li Yang, Kai Chen,* Hua Yang*)该研究工作得到了国家自然科学基金、湖南省自然科学基金以及中南大学研究生自主探索创新项目等的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




