同济大学徐涛课题组光镍双催化下实现的烷基卤代烃与α-氯代硼酸酯的不对称还原偶联反应
摘要:上海同济大学徐涛课题组首次报道了光镍双催化条件下,非活化烷基卤代烃与α-氯代硼酸酯的不对称C(sp3)-C(sp3)还原偶联反应,合成了一系列手性二级烷基硼酸酯衍生物
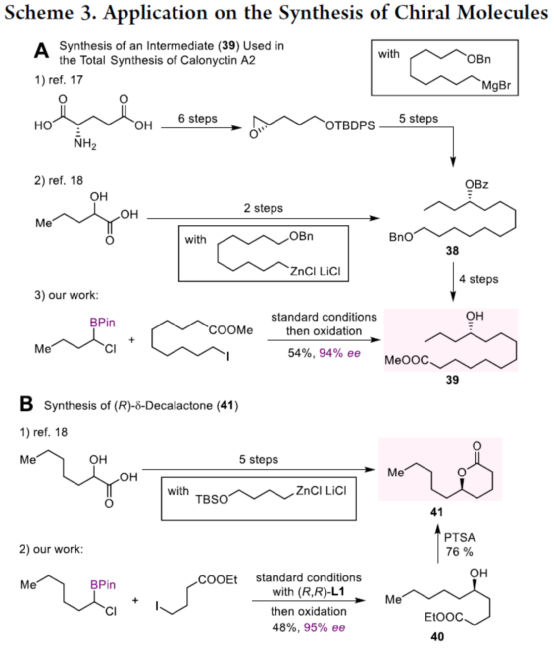
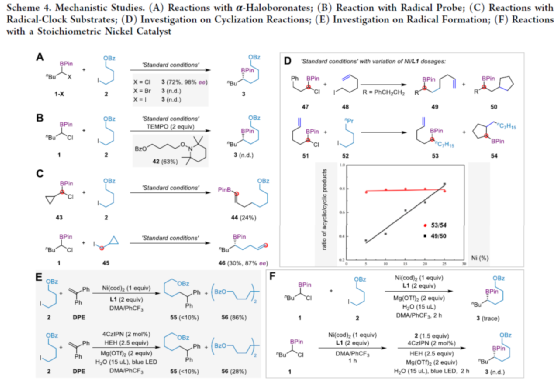
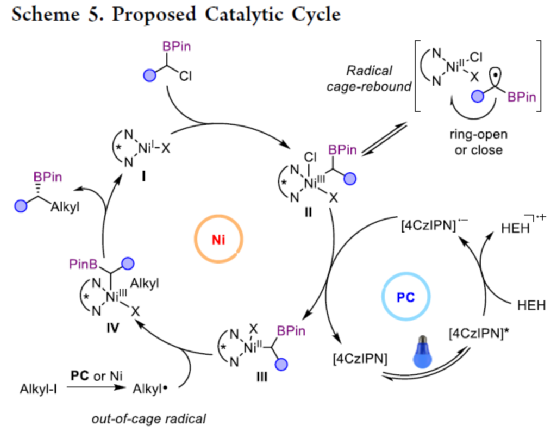
目前,镍催化的不对称C(sp3)-C(sp3)偶联成键主要依赖于传统的烷基金属试剂和卤代烃的偶联以及近年来发展的通过NiH催化的烯烃和烷基卤代烃的不对称成键来实现。两种不同烷基卤代烃之间选择性地不对称还原偶联反应还没有相关的报道。近日,上海同济大学徐涛课题组首次实现了在光镍条件下,非活化烷基卤代烃与α-氯代硼酸酯的不对称C(sp3)-C(sp3)还原偶联反应,用于合成一系列手性二级烷基硼酸酯衍生物。同时,得到的手性烷基硼酸酯是有机合成中十分重要的中间体,可用于快速构建一系列难以制备的手性碳中心。文章链接DOI:10.1021/jacs.2c13220
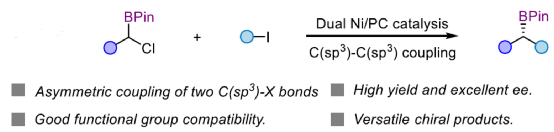
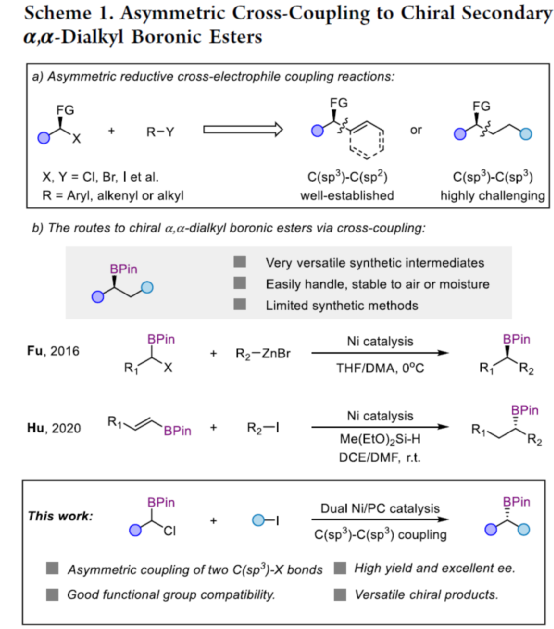
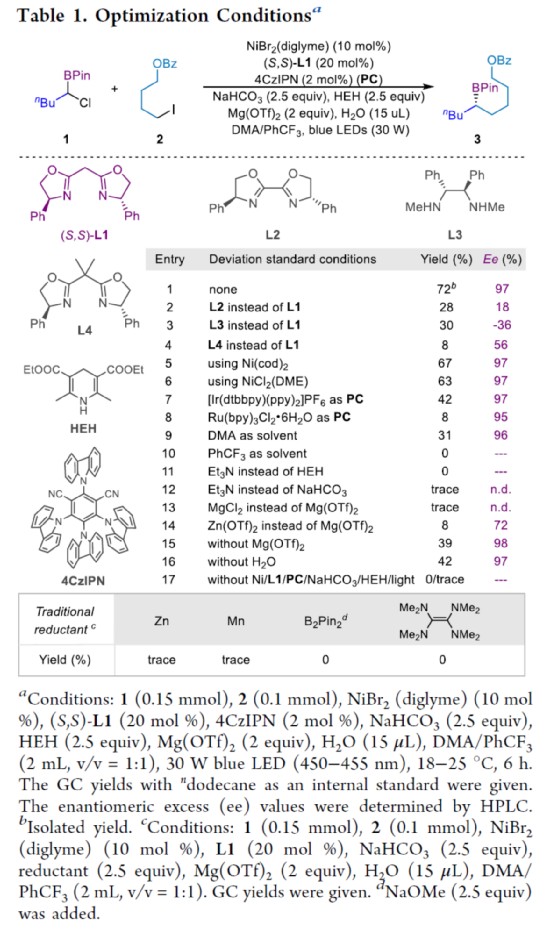
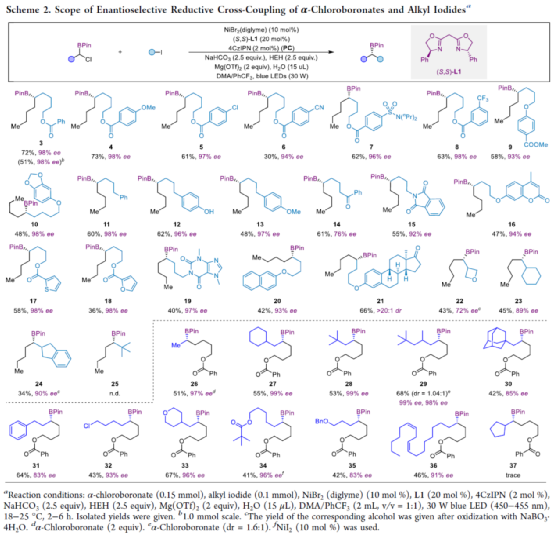
(图片来源:J. Am. Chem. Soc.)
上海同济大学徐涛课题组首次报道了光镍双催化条件下,非活化烷基卤代烃与α-氯代硼酸酯的不对称C(sp3)-C(sp3)还原偶联反应,合成了一系列手性二级烷基硼酸酯衍生物。同时,该策略具有反应条件温和、底物范围广泛、官能团耐受性出色、对映选择性优秀等特点。此外,通过Calonyctin A2全合成中的关键中间体以及(R)-δ-癸内酯中间体的简易高效合成,证明了反应的实用性。该反应的成功实现,进一步丰富了镍催化C(sp3)-C(sp3)不对称成键的方法,也为其他不对称C(sp3)-C(sp3)偶联反应提供了一定的借鉴作用。
查看更多
相关阅读
热门文章
热门标签
等离子体催化
烯烃
光催化构建构建硫杂环丁烷
光催化环加成反应
紫外光连续流反应器
光催化析氢
光催化脱羧C–C交叉偶联构建偕-二硼化合物
光催化合成苯并噻唑衍
微通道反应器透光材质
光引发的环化反应
光催化合成芳胺及衍生物
烯烃双官能团化反应
可见光催化剂耦合高级氧化工艺
光化学反应仪生产厂家
光催化芳基溴的选择性氰化
聚合物微通道反应器
光化学反应仪结构特点
纳米光催化剂
光催化甲烷氧化偶联
光催化合成烷基氟磺酰化合物
地屈孕酮工艺流程
喹啉
光化学衍生装置
可见光驱动硫脲和羧酸选择性合成
光催化烯烃异构化
光催化反应釜降解
光氯代反应
光催化生成2-吲哚酮
光反应器点光源
平行光反应仪特点
可见光催化还原芳香硝基化合物
有机合成
光催化苯甲醇
光化学反应仪技术标准
光催化聚乙烯转化为丙酸
光谱学技术有机化合物鉴定
自由基加成反应
光引发的重排反应
光反应釜容量
光诱导Pd催化烯丙基C-H氧化
紫外光反应器
光催化氮类化合物化学转化
光催化环加成反应合成手性双环己烷类化合物
光催化实现苯环对位C-H键胺化
高压光反应釜耐压
板式微通道反应器
光催化微流体反应器设备
光催化炔烃合成N-芳基吡咯类化合物
可见光诱导膦催化的烯烃自由基环化
光催化合成氮杂芳环羧基化合物
光催化亚磺酰自由基与烯烃加成
高通量光化学反应仪
大容量光化学反应仪价格
光催化制乙烷
微通道光反应器分类
可见光催化合成苯酚
丙烯酰苯胺自由基环化反应
光催化芳基卤和羧酸构建硫酯
光催化合成α-氨基膦酸酯
单工位光反应仪
叠氮化物
光催化α-羟基酸
全波段光催化反应器
小试级光反应器
光化学合成地屈孕酮
金属笼光催化制氢
溶胶凝胶法
光催化交叉亲电偶联反应
光催化合成苯甲腈
封端-糖基化
光催化降解邻苯二甲酸酯
撬装微通道反应器
烯烃的反马氏氢硫化反应
光化学合成连二醇
光诱导下串联合环修饰新方法
广东工业大学
光化学C-N交叉偶联
光催化还原六价铬
有机光化学合成应用
光诱导吡啶扩环
板式微通道光反应器
并联LED光反应仪
光催化低温乙苯转化
光催化甲烷
石英微通道反应器
水裂解
光催化木质素生物质转化为芳香族单体
光化学反应仪市场分布
光催化草酸盐促进醇的脱氧羧酸化
平行光反应仪厂家
光催化氧化胺偶联
气固相光催化反应器
平行光化学反应仪器
光催化酰基三氮唑构建酮
光诱导合成CF3
光诱导镍催化烯烃碳卤化反应
液冷光催化反应器
光催化芳香醇
光催化光敏药物合成
光催化sp3C−H键氧化反应
光催化反应器装置
JACS
精密光化学反应仪
光催化环丙酰胺无受体脱氢开环
光诱导下芳烃C-H 键直接胺化反应
玻璃光催化反应釜耐压选型
固定床光反应器厂家
开放式光源
光催化去除难降解的芳香族污染物
光催化氢氟磺酰化
光催化合成磺酰亚胺酰胺
光催化甲烷制乙酸
光去羰基反应方程式
光催化有机合成发应
光催化C-C键偶联反应
可见光诱导催化卤代吡啶
光催化烯烃芳化氨甲酰化反应
光化学促进环己酮脱氢去饱和C-N偶联
光化学反应方程式
光催化还原反应
光致异构化合成原理
光催化合成2,3-二胺
光反应器
光催化CO2还原制备C2H4
光催化脱氢乙烷制乙烯
单孔光化学反应仪
糠醛
光流体反应器
光诱导催化选择性脱羧二氟甲基化
光催化实验设备
可见光催化苯
光诱导下烷基胺的远程溴化修饰新方法
光催化甘氨酸酯α-C–H官能团化构建非天然氨基酸
中国矿业大学
风冷控温6孔光反应仪
全波段光反应仪
led光催化反应釜
光催化降解对四溴双酚A
光催化制酯
光诱导催化烯丙基C-H键酰氧基化
10孔光化学反应仪
光氧化还原反应
气相沉积法制光催化剂
光化学基本概念
光催化反应釜厂家
光催化气态烷烃和芳基溴化物偶联
连续流光催化反应器
光催化反应光源
光化学合成基本原理
光化学反应仪转速
光催化碳碳偶联反应
玻璃通道连续流反应器
光催化构建手性β-卡波林
光催化塑料降解
光催化环己烷脱氢
led光催化反应器
光反应釜设计温度
单孔光反应仪
光催化三氟乙酰化反应
光自由基加成反应
光催化α-羟基酸合成α-酮酸
光催化Heck类偶联反应
有机化合物脱氢偶联
光反应釜功能作用
光促进3-烷基吡啶苄基C–H 键自由基氯化
光催化烯烃的溴烷基化反应
光催化反应釜冷却装置
光催化C−H键杂芳化反应
小试级光化学反应仪
叔烷基胺
g-C3N4
水热法制光催化剂
光催化杂环苄位C-H键氯化
光还原反应方程式
基于芳基噻蒽鎓盐的烯烃
N-杂环卡宾非均相光催化
拉曼区光化学反应仪
光催化合成维生素B
光化学反应仪进口
大容量光化学反应仪
光催化烯烃的芳硅化反应
可见光诱导肟酯C-C键的断裂
光催化甲烷无氧偶联制乙烯
玻璃光反应釜温度控制
光氧化硫醇-烯交叉偶联反应
LED光催化反应器应用
多相光催化氧化降解TMP
光诱导烯烃化学选择性芳杂化
实验室光化学反应釜
平行光催化反应器
玻璃光反应釜压力
光催化芬顿降解
光催化磺胺嘧啶降解
微通道反应器定制
多位光化学反应仪厂家
光化学反应仪规格
海南光化学反应仪
光催化反应速率
光催化N-酰胺
光化学耦合
光催化香料合成反应
盘管式连续流光反应器
光诱导合环构建环丁烷
光催化合成氮杂环庚烷
光催化合成地屈孕酮
釜式光反应器
光催化合成α-氨基羰基化合物
吉林大学
光催化硅基羧酸化合物
光流体微通道反应器选型
光去羰基反应
高通量光反应仪工作原理
光催化烯烃
光催化剂制备原理
光催化烯基重氮[3+2]环加成反应
光催化H2O2
红外区光化学反应仪
光催化制备乙醇胺
温控光化学反应仪
高压光反应釜应用场景
光催化医药合成
深紫外光化学微反应器
光化学反应釜
地屈孕酮光合成设备
光化学反应仪报价
光催化串联实现[3+2]环化构建α-SCF3环戊酮
光催化卡宾与腈
OER
led光化学反应仪
宾夕法尼亚大学
烯烃环异构化合成杂环
光催化脱羧反应
有机光反应器
光化学合成多环邻氨基醇类化合物
光催化合成α‑叔伯胺
太阳能驱动耦合催化CO2还原为合成气
工业级盘管式连续流光反应器
光催化制酮
光催化胺化
重庆大学
光催化制地屈孕酮
光化学反应仪器生产厂家
多位光化学反应仪特点
光催化反应釜组成
微通道反应器持液量设计
光催化光异构化反应
光诱导电荷转移复合物
LED光催化反应器
光诱导下脱氧官能化修饰新方法
光诱导构建1、2-芳基杂芳基乙烷
光致异构化合成药物设计
可见光催化二芳基醚的C-O键断裂
微通道反应设备
光催化α-C–H键芳基化
光催化聚合反应
光催化去除水中邻苯二甲酸酯
多电子
光催化降解氧氟沙星
光连续流反应器
剑桥大学
光催化氧化还原
光催化制备维生素B
100ml微通道光反应器
光催化氧化还原反应
光催化氧化自由基极性交叉
聚四氟乙烯反应釜
光催化甲烷转化制备乙醇
光诱导下Co催化下Semipinacol重排新方法
光化学反应仪恒温循环水控温
光催化微流体反应设备
光催化CO₂还原生成C₂烃类化合物
6孔平行光化学反应仪
盘管式光催化反应器
光化学反应仪参数
甲烷
光催化剂合成原理
光催化合成烯烃
光催化水分解制氢
微通道反应装置
天津光化学反应仪
光催化羧酸与S8的脱羧C-S构建
光催化反应釜使用说明书
光催化实现C-杂原子与富电子芳基偶联
中山大学
光催化共轭二烯的对映选择性碳胺化反应
光催化合成β- 氨基酯
连续流光反应器分类
光催化合成多环邻氨基醇类化合物
平行光反应仪厂家排名
光催化吡啶骨架编辑构建双环吡唑啉
光化学反应仪地区分布
光催化硫醚的选择性氧化
光芬顿法
光催化乙苯
光功能材料基本原理
光催化反应釜原理
开放式光催化光源
光流体微通道反应器工作原理
实验室平行光反应仪
光催化芳基氯与醇合成芳基烷基硫醚
内置搅拌光反应仪
对硝基苯光催化还原制苯胺
光催化缺电子吲哚衍生物
光催化生成C₂烃类化合物
光诱导催化邻烷基硝基苯的吖啶化转化
有机光催化剂应用场景
光催化构建轴手性N-芳基喹唑啉酮
光流体微反应器厂家
光环化反应方程式
光诱导活性聚合物网络
可见光催化环己烯制环己烯酮
光反应釜容量选型
光环化反应原理
光诱导Co催化还原不对称交叉偶联
光反应釜搅拌速度
光催化苯甲醚酰胺化反应
光催化led光源
光催化羧酸与芳基碘的酯化反应
光催化对烯烃进行烷氧基化重氮甲基化
烯烃的氢二氟甲基化
光催化偶联
光催化氯二氟乙酸与烯烃的多样官能团化反应
北京光化学反应仪报价
光催化反应釜
光催化木质素解聚
曼彻斯特大学
微通道连续流光反应器
光催化脱羧卤磺酰化反应
紫外光化学反应仪
光诱导实现天然糖类化合物位点选择性
光化学反应仪内置搅拌原理
光合成
光诱导
光催化亚磺酰胺
光氧化还原双催化
光催化反应器类型
石英微通道光催化反应器
led光化学反应仪控温
多功能光反应仪
光催化合成合成环状胺
光催化水处理
光催化反应器
光催化光源
多相光催化氧化降解抗生素
光催化反应釜选型
紫外光化学反应釜
光催化合成酰基酮产物
光催化制维生素D
上海光化学反应仪厂家
光催化合成β-酮一级氯化物
有机光催化剂基本原理
光氧化还原协同催化丙二烯的芳磺酰化
光催化合成磺酰氟化合物
光催化氧化二氧化硫
加州理工大学
有机光化学反应机理
光催化烯烃全氟异丙基化反应
筒式微通道反应器
微通道反应器设计参数
安徽大学
芳香酮化合物光敏剂
高通量光反应仪厂家
光催化合成硫醚
光催化反应釜常见故障问题
光催化合成α-硼基醛
酮烯胺
光催化合成芳基胺
光诱导下硝基氧化合成
光催化脱氧氢烷基化修饰
光化学合成
光偶联反应
光催化炔烃生产伯醇
光催化烯烃烯丙位C-H键与芳基磺酰化反应
光催化合成芳基-烷基硫醚
光诱导不对称还原交叉偶联
光诱导芳基碳碘键活化
光催化制苯甲酸
绿光照射下酮的 α 芳基化的光氧化
光氧化还原催化实现脱羧交叉偶联
北京理工大学
烯烃的连二磺酰化修饰
光催化生物质多元醇制备乙醇胺
芝加哥大学
光催化重排合成芳乙胺
光催化烯烃的氢化四氟异丙基化
开放式光催化光源功率
led光反应釜
光化学反应仪常见问题
连续流光化学合成
可见光合成多取代吡咯
可见光催化芳香杂环氮自由基对非活化烯烃加成反应
光催化制H2O2
光化学反应釜如何选择
平行光反应仪保养
光催化降解氯酚类化合物
南京光化学反应仪选哪个品牌
光化学合成β-氨基酸酯
光催化微流体反应器
光催化构建糖胺
光氧化还原双重催化唑类化合物与芳基碘的C–H芳基化反应
光催化一级杂芳基胺
光催化制氢
光诱导的扁桃酸与醇氧化酯化反应
光催化反应釜光柱
恒温循环水控温的工作原理
光催化合成维生素B反应方程式
光催化羧酸盐生成磺酰亚胺酰胺
可见光催化苄基三级C–H键直接羧基化反应
光反应釜组成
室温光催化氧化甲烷
光催化反应器工作原理
光催化喹啉衍生物C(sp2)-H官能化反应
维生素B分子式
多位光化学反应仪优势
光反应釜材质
玻璃连续流反应器
黄素光催化去饱和与环氧反应
光催化制甲醇
光催化和钴催化非活性烯烃环异构化合成杂环
光功能材料制备
模板法制光催化剂
金属光氧化还原交叉偶联
光催化合成高炔丙醇化合物
深紫外光化学反应仪
光催化羧酸盐生成亚磺酰胺
微通道光反应器设计原理
光催化微通道反应器
光化学制备烯烃
光催化胺烷基化反应
光催化构建α-SCF2H环戊酮
工业级光流体反应器
光流体微反应器多少钱
光化学反应仪厂家
光催化降解水中有机污染物
光诱导含偶氮苯聚合物可逆固-液转变
硝基芳烃
光催化环丙烷
光诱导芳基三氮烯与CDCl3的氘化反应
光催化的不对称烯烃异构化
光催化水相硫-芳基抗体偶联
光催化构建酰基缩醛衍生物
光化学反应仪采购
光催化醛-烯烃偶联
地屈孕酮分子式
紫外光化学反应仪多少钱
可见光催化醛的不对称还原炔丙基化反应
可见光诱导肟酯C-C键官能化反应
多试管光化学反应仪
光催化析氢设备
烯烃二卤化
光化学反应光源
石英微通道光反应器
光化学反应仪维护
光催化剂降解诺氟沙星
多通道光催化反应器
光催化亚磺酰胺实现烯烃的胺芳基化
光化学反应仪维修
康奈尔大学
6000ml连续流光反应器
光催化合成反应仪
齐齐哈尔大学
光化学反应仪哪家比较靠谱
光催化硫醚化反应
生产级盘管式连续流光反应器
光诱导重排环化
光催化烷烃与芳基溴化物交叉偶联
地屈孕酮光催化设备
光催化自由基诱导碳碳双键和官能团易位
光催化降解水中污染物
光催化环丙烷胺酰化反应
光催化过氧化氢
光催化构建氢噻吩和吡咯结构
光催化有机污染物矿化
光催化降解沙星类抗生素
光自由基加成反应原理
光催化饱和杂环酮与胺的脱氢去饱和偶联
光氧化还原
光催化构建氟取代叔脂肪高烯丙基胺
光催化芳基溴的选择性氰甲基化
连续流光反应釜应用场景
6孔平行光反应仪
厦门大学
光催化自由基脱羧偶联反应
光催化合成反应方程式
常州光化学反应仪厂家
光催化丙酮
光催化烯烃2σ+2π环加成
光催化合成氨基酸衍生物
石英板式微通道光反应器
光聚合反应
光化学反应仪厂家排名
光催化降解法
光催化酰胺自由基插入双环丁烷转化
光催化偶联制乙醇
非均相光催化
风冷平行光反应仪
微通道反应器材质
钍簇
光催化丙酮偶联制备2,5-己二酮
江苏大学
LED光化学反应仪
光电催化苯乙烯碳胺化
光化学反应仪哪个品牌好
高通量光反应仪
全波段光化学反应仪
光催化诱导脂肪胺α-C(sp3)−H键膦酰化
光流体微通道反应器中试
平行光光源
光化学反应仪控温方式
小试光反应器
磺胺甲恶唑抗生素
光氧化还原共催化烯烃氨酰化合成β2,2-氨基酯
光催化选择性氧化芳香醇
光催化烯丙基醋酸酯
硝基苯乙炔修饰
光催化合成H2O2
可见光诱导的钴催化烯烃双膦化反应
LED工业光反应器
光催化反应器使用说明
光催化α-氨基自由基与烯烃加成
光催化合成甲醇
光催化氧化反应
光化学反应仪贵吗
光催化甲烷制甲醇
光诱导γ-杂芳基化修饰新方法
可见光光催化分子氧活化
光氧化还原催化
光催化还原制酮
光催化磺酰胺氮C-H键芳杂环反应
光催化氧化技术
光氯化反应釜定制
光催化CH4和CO2偶联制乙醇
可见光催化葡萄糖
有机光氧化还原催化剂10-苯基吩噻嗪
邻氟磺酰硼化反应
光诱导催化偕二氯烷烃的发散性去氯硼化反应
开普敦大学
南京光化学反应仪
光催化烯烃α-三氟甲基化
光催化芳基羧酸脱羧氧化
单光源光反应仪
有机光光合成过氧化氢
工业级光化学反应仪
盘管式聚合物微通道光反应器
固定床光反应器优势
光降解刚果红染料
光催化合成氨基酸
可见光催化芳烃C-H胺基化
中国地质大学
光催化对硝基苯
LED单工位光反应仪
光反应釜选型
有机光催化合成地屈孕酮
光化学合成N-糖苷
光催化异氰C-N键断裂生成烷基自由基
光催化CO₂还原制C2H4
光化学合成策略
光催化烷烃
光化学反应釜厂家
光催化C-H键活化机理
小试级光催化反应器
光催化烯烃的氨基-羧基化反应
光催化制氢设备
光引发的偶联反应
光催化还原重金属离子
光催化还原制苯胺
光化学反应仪在医药领域的应用
光催化合成过氧化氢
光催化降解PET-12塑料
光催化多组分不对称Minisci反应构建手性β-卡波林
单工位全波段光反应仪器
光化学反应仪用途
溴烷基化反应
光化学反应仪选型
光催化降解有机物
玻璃光反应釜
光化学反应仪优势
乙烯和CO₂合成可光降解聚乙烯
光催化析氢实验装置
光化学反应釜价格
C–H双官能团化反应
光催化降解BPA
光催化降解甲胺
光催化[3+2]环加成反应
光诱导环丙酰胺与炔烃环化构建吡啶
布里斯托大学
光诱导H键-EDA复合物促进烯烃氢化硫化
光流体微通道反应器定制
急需光化学反应仪
甲烷光催化氧化偶联
光化学反应仪产物分析
烯烃的氢甲基化反应
多相光催化
光催化构建双环吡唑啉和吡唑结构
光催化5-羟甲基糠醛转化2,5-二甲酰基呋喃
光诱导构建γ-硫代内酰胺
复旦大学张立武
郑州光化学反应仪报价
光催化亲核氟化
光催化脱羧Giese反应
近红外区光化学反应仪
偕溴代硝基环丁烷
聚合物
光催化醛与羰基或亚胺的不对称还原交叉偶联
金属氧化物光催化剂
善施科技完成 Pre-A 轮融资
光化学反应仪温度控制系统
光催化合成含硼杂环化合物
光化学反应仪波长
Nature
溴代烷烃
光催化合成醚类化合物
光催化CO促进杂芳基迁移反应
光催化矿化产物 CO2 转化为 CO
光催化硝基芳烃
光化学反应仪时间设置
光催化制乙醇
光催化还原CO2制乙烷
可见光催化从环己酮
光催化降解装置
光氯代反应原理
光催化BCP醚类衍生物合成
串联LED光反应仪
脂肪族羧酸脱羧卤代
光去羰基反应原理
光加成反应方程式
半导体光催化剂
光氧化合成原理
有机光化学基本概念
光催化降解亚甲基蓝
烯醇硅醚转化为α,β-环氧酮
光氧化合成应用
光催化氧化甲苯制苯甲醛
风冷光化学反应仪
光诱导构建杂环或双环化合物
光催化制苯乙烯
光催化实现烯烃与醇的脱氧交叉偶联
多功能光化学反应仪
单孔位光反应仪
华南师范大学
光催化苄胺偶联
光催化降解挥发性有机物
分子光谱学原理
光催化降解四环素
光催化降解VOCs
光诱导下SO2固化合环修饰
光催化偶联反应
磁力搅拌器
多工位光化学反应仪
光化学反应仪选购
可见光催化还原硝基化合物
光催化羧酸化合物结构重塑
郑州大学
光催化剂制备过程
光催化修饰香料分子
工业级连续流反应器
光催化末端烯烃生产伯醇
光化学反应釜选型
光化学
南方科技大学舒伟
光化学反应过程
高通量光催化反应器
CO2还原
深紫外光反应器
华中师范大学
光催化产业化
光诱导烯烃的插氮合环氮杂环丙烷化转化
高通量光反应仪报价
led光反应器
光催化解聚木质素
光催化降解苯酚
合成可光降解聚乙烯
加州大学洛杉矶分校
光诱导碘代烷烃的胺化反应方法学
光化学反应仪维护保养
上海光化学反应釜
三氟甲基化
风冷光催化反应器
邻苯二甲酸酯的碳和氢同位素分馏
光催化合成噁唑
洛桑联邦理工学院
光催化构建富含 C(sp3)的偕二硼砌块
天津光化学反应仪报价
光催化反应器常见故障问题
武汉大学
光催化环丙烷的去消旋化
光化学反应仪器厂家
光催化降解盐酸四环素
光催化甲烷选择性氧化制甲醇
光催化硝酮
光催化烯烃自由基还原交叉偶联
芳香烯烃高效氧化裂解
光还原反应原理
CO2光催化还原
多功能光化学反应仪器
芳基环丙烷与硝酮环加成反应
光催化反应釜功能
高压光反应釜压力设计
光催化脱羟糖自由基的N-糖基化反应
西湖大学
光催化构建氮杂环丁烷
光催化一级杂芳基胺与烯烃的分子间反马氏氢胺化反应
南京理工大学
光诱导下偕二氯化合物环丙烷化
光催化制醚
光催化反应器用途
连续可见光催化
光催化苯甲醚酰胺化
内照式光化学反应釜
光催化降解水体有机污染物
光催化还原制烯烃
邻苯二甲酰亚胺
光催化还原技术
光催化合成烯丙基砜衍生物
国内光化学反应仪现状
光催化α-羟基酸合成酒石酸衍生物
光诱导吡啶结构的骨架编辑
二氟烷基自由基加成
玻璃通道光催化反应器
加州大学伯克利分校
玻璃光化学反应釜
光化学合成维生素B
光催化炔烃
光催化制醇
多功能光化学反应仪功能
光催化降解二氯苯酚
平行光反应仪技术参数
光催化氯化苄自偶联反应
光催化产氢
有机光催化剂
光催化末端烯烃
光催化碳氟磺酰化
光催化反应釜医药合成
异噻唑啉酮光催化降解
光催化析氢装置
光化学反应仪led光源
有机光化学反应类型
光诱导芳烃分子内环加成去芳构化
光促进脂肪胺远程C(sp3)–H键溴化
全波段光反应器
光催化还原
光催化合成烯丙基硅化合物
光催化甲苯
光化学反应仪LED光源
光催化烯烃与羧酸的氢-氟烷基化反应
C-H键活化偶联
有机光化学反应原理
光催化降解诺氟沙星
光催化蒽的不对称[4+2]去芳构化
光催化有机合成地屈孕酮
微通道反应器光催化制地屈孕酮
三氯甲基化反应
光诱导烷基羧酸化合物的脱羧
海南光化学反应仪厂家
光催化乙炔制乙烯
光氧化还原催化重排级联反应
光催化甲烷制甲醛
光催化烯烃α-酰化反应
光催化甲烷制乙烯
多功能光催化反应器
光催化合成2-取代萘
可见光催化合成酰胺和N-酰基脲
光催化反马氏氢胺化反应
可见光催化N-烷基化
光催化异氰与炔烃的碳/氢氰化反应
可见光催化硫氰化反应
光化学反应仪光强分析
高压光化学反应釜
可见光催化苯和脂肪烃选择性偶联
光合成甲醇
室温光化学反应仪
紫外光催化反应器
烷基炔烃的双官能化转化
光化学硝基苯去芳构化
光催化降解设备
光催化烷基溴三氟乙酰化反应
内置光催化光源
EDA 复合物
光催化丙烯醛自由加成反应
光化学反应仪哪家好
武汉光化学反应仪厂家
有机光化学合成基本原理
光催化反应方程式
光催化合成手性烯丙基砜类化合物
光催化CO2环加成反应
清洁可再生能源化学合成
光催化烷基卤的C-N偶联反应
烷烃的光氧化
分子光谱学应用
西安交通大学
风冷LED光反应仪
光氧催化led光源
光催化间苯二酚-甲醛树脂
光催化环氧乙烷的开环不对称炔基化反应
光催化析氢有机耦联反应
苄胺底物光催化偶联
可换光源
光合成生物学
光催化合成E-烯丙醇
科研级光反应仪器
可见光催化合成腈类化合物
科研级光反应器
光催化硝基芳烃去芳化扩环合成多取代氮杂环庚烷
光催化N-糖苷合成
有机合成光化学反应仪
光催化甲烷氧化制甲基
光催化合成钛磺酸框架
光催化烯烃与三氟甲烷亚磺酸钠发生三氟甲基硫代化反应
10工位光催化反应器
光催化合成
大通量光化学反应仪
光催化对映选择性C-H官能团化实现吲哚的不对称去芳构化
光催化降解VOCs废气
光催化有机污染物降解
光催化构建烯丙基N,O-酰基-缩醛
烯丙基sp3 C–H键烷基化
可见光诱导唑类化合物C-H芳基化反应
光催化制2,5-二甲酰基呋喃
可见光诱导的脱羧烯丙基化反应
单工位光催化反应器
光催化胺烷基化构建α‑叔伯胺
光铜共催化的自由基脱羧偶联反应
催化羧酸不同自由基的C-C交叉偶联
高效光催化氧化偶联反应
不锈钢微通道反应器
重氮化合物可见光诱导反应
光催化醛-烯偶联反应
福州大学
光催化烯烃双三氟甲硫基化反应
南京光化学反应仪哪家好
光催化合成β2,2-氨基酯
全波段LED光反应仪
光催化反应器常见故障解决办法
定制光流体微通道反应器
光催化C-N偶联耦合
连续流光反应釜
光化学反应仪保养
光催化实现烯烃的芳氮化
微通道反应器
水相硫-芳基抗体偶联
羧酸
中国科学院
光生电荷
亚甲基蓝
高精密光化学反应仪
光诱导脱氢偶联
光催化制醛
光催化环丙叔醇
光催化烯烃不对称双官能团化
光催化呋喃与胺的亲核-亲核偶联反应
光催化合成光学活性联烯
led光化学反应釜
水光催化轻烯烃的双羟基化制备二元醇
四川大学
光催化降解抗生素
光催化α-叔碳伯胺合成
光催化偶联合成烯丙基三级烷基胺
风冷控温平行光反应仪
光催化醇脱氧芳基化
N-烷基苯胺
光催化氧化氮氧化物
北京光化学反应仪
复旦大学
水制氢
光催化氧化5-羟甲基糠醛
光化学反应仪行业标准
光催化合成α-氨基膦氧
低温光化学反应仪
氮杂环丙烷
光催化自由基串联环化反应
微通道反应器压力值
可见光催化芳香烯烃氧化裂解
光催化有机磷酸双自由基交叉偶联
光催化羧酸
光催化降解芳香族污染物
光催化甲醇脱氢
光催化N-苯基哌啶β-C(sp³)–H酰胺化反应
工业级光催化降解反应釜
光催化合成苯并膦氧化合物
上海大学
可见光催化二氯化
光催化三氟甲烷亚磺酸钠
光催化苯酚
光催化CH4制C2H4
光催化甲基酮脱酰炔基化反应
光化学反应仪应用
光催化CO2还原为CH4
光氯化反应釜厂家
平行光反应仪精准液冷控温
光酶选择性控制自由基反应
釜式光反应器选型
高压光化学反应釜厂家
实验室光化学反应仪选购指南
有机光化学反应仪
噻蒽鎓盐光催化
光氧化还原催化苄位选择性酰化反应
光催化烯烃的氧炔基化
国产光化学反应仪公司
邻苯二甲酰亚胺自由基
可见光催化芳香杂环氮自由基
光催化促进吡啶C4-选择性氟烷基化
甲烷氧化偶联制轻烷烃
光催化降解反应釜
偶氮苯
光催化聚乙烯转化为乙烯
光化学反应仪波波长
光催化合成苯并咔唑类化合物
光催化实现烯烃的烷氧基重氮甲基化
光催化三氟甲基亚磺酸钠
光化学反应仪led光源功率
光催化制备环丁烷
10工位光化学反应仪
光解对四溴双酚A
室温光催化氧化甲烷制备液相产物
光化学合成β-氨基醇
光催化BCB自由基阳离子的[2π + 2σ]环加成反应
可见光驱动的单金属交叉亲电偶联反应
实验室光催化反应器
光催化合成2-哌啶酮
光催化Meerwein型溴芳
多功能平行光化学反应仪
光催化空气净化
平行光反应仪
海南光化学反应仪价格
光催化环烷烃与苄溴的C−C键交叉偶联
光催化加成反应
华中科技大学
可见光催化穿梭二溴化
紫外光化学反应仪使用说明
光催化构建α-氨基酸
磺胺嘧啶
光催化领域
光催化降解PAEs
光驱动耦合催化CO2还原为合成气
固定床光反应器选型
光催化喹啉衍生物
二硫化物光化学合成
光诱导共轭合成1,2,4-三氮唑
有机光化学反应应用
光化学反应仪使用指南
自由基
光催化甲苯选择性氧化
光谱学技术药物研发
平行光反应仪光源
可见光催化硫醇的选择性氧化脱氢偶联
有机光化学合成策略
多通道光化学反应仪
光催化制备四氯化碳化合物
光催化C-H键活化构建α-手性烷基膦
光催化还原二氧化碳制乙烷
光催化甲烷转化为高附加值化学品
可见光催化还原炔丙基化反应
光诱导下芳基卤代物与羧酸化合物合成硫酯
香港城市大学
光催化析氢反应器
插烯反应
光催化还原CO2
光催化氧化制甲醇
光促进羧酸与S8的脱羧C-S构建
石英微通道光反应器压力设计
平行光反应仪光源参数
光催化自由基极性翻转环加成策略合成环状胺
光催化诱导BCPs三组分自由基接力反应
常温平行光反应仪
高压光反应釜
不锈钢光反应釜
可见光催化活化C-H氨基化的反应方法学
光催化sp3–sp3氧化偶联立体选择性合成氨基酸
有机光催化剂表征方法
科研级光化学反应仪
光催化耦合类芬顿反应去除污染物
光催化香料合成反应仪
光氧化还原催化烯烃
光催化降解环丙沙星
led光反应仪器
光反应器LED光源
光促进杂环苄基C(sp3)–H键多样性转化
光流体微反应器
光电催化
光催化烯烃碳卤化反应
光催化甲烷偶联制乙烷
胺的直接C-H官能化
光催化硝基苯加氢反应
光诱导硝基氧化合成
光催化轻质烷烃与芳基溴的偶联
光催化有机材料合成
可见光催化脱羧溴化反应
光诱导下脂肪烷烃与烯烃的偶联反应
液冷控温光化学反应仪
光反应釜分类
光催化芳基卤
光催化制备2,5-己二酮
光催化烯烃烷氧基重氮甲基化
光催化降解氟喹诺酮类抗生素
光催化芳基环丙烷
光催化吡啶重排环化
不锈钢光化学反应釜
上海多试管光化学反应仪
烷基磺酰化反应
光反应仪独立调光
光流体微通道反应器量产
光催化烯丙醇的半频哪醇重排反应
光催化脱氢还原
光催化烯丙基C–H酰氧基化反应
光催化甲烷制乙醛
连续流光反应器制备异噻唑
液相光化学反应釜
光催化降解塑料
不锈钢反应釜
光催化反应釜材质
光化学反应仪
光催化应用
光催化苯胺
光催化聚对苯二甲酸乙二醇酯瓶子公斤级降解
光催化降解抗生素废水
光反应釜
光催化制备地屈孕酮
光催化自芬顿降解水中有机污染物
光氧化还原吡哆醛自由基生物
XPA光化学反应仪
光引发的自由基反应
光致异构化合成
光化学反应仪光源
光诱导Pd催化制备芳基自由基前体
光化学介导饱和杂环酮脱氢
高温高压光反应釜
三甲基氯硅烷
光化学反应仪使用说明书
光催化Meerwein型溴芳基化反应
光催化芳基醚C−H氧化
光敏化合成
光化学反应釜分类
光催化卡宾自由基阴离子插入反应
可见光驱动有机转化
光催化合成吲哚酮类化合物
平行光反应仪品牌
光催化反应釜反应腔
去芳香性戊烯基化反应
led光化学反应仪波长
光催化烯烃的胺-磺酰胺化修饰
光化学反应特点
可见光催化烯烃双官能团化反应
光催化制备前-芳香中间体
可见光催化氯化反应
光催化合成磺酰氟硼化物
光催化合成氟烷基酮化合物
光氧化还原催化苄基叔碳C-H键与CO2的羧酸化反应
可见光催化氧化脱氢
光催化原理
光诱导下三元催化下γ-氨基的官能化转化
光催化合成醇类化合物
硼化
光化学反应仪分类
光氧化还原双重催化
溴代氟酰基芳烃与多种烯烃的自由基环化反应
光催化二氧化碳还原制乙烯
光催化硫醚
维生素B光合成设备
连续流微反应器
光催化胺与羧酸构建亚磺酰胺
石英玻璃反应釜
光催化微塑料升级转化偶联
多相光催化氧化降解废水中抗生素
光化学合成芳基胺
光催化合成合成2,3-二胺化合物
可见光催化葡萄糖产HMF
光催化反应基本原理
光诱导烷基胺与伯醇的无受体脱氢偶联构建α-氨基酮
光催化制乙烯
光催化农药合成
光催化卤代反应
光催化色酮
陕西科技大学
光诱导下EDA复合物多组分交叉偶联新方法
玻璃光催化反应釜技术参数
光催化制备乙二胺
光化学反应釜类型
有机光催化剂制备
多试管光化学反应仪多少钱
光催化反应器波长筛选
上海光化学反应仪报价
可见光催化脂肪烃
光催化合成β-氨基酸酯
光催化剂合成
光催化电子转移反应
光催化合成多取代氮杂环庚烷
光促进吡啶重排构建3-吡啶醇
异相光催化氯化苄自偶联
光诱导电荷存储
光流体微通道反应器
玻璃光催化反应釜
光催化制高炔丙醇化合物
PHECOO
光催化生成烷基自由基
光催化降解五氯苯酚
光催化反应器香料合成
光催化反应釜维护保养
光催化二甲苯氧化反应
可见光光催化芳烃的C−H胺化反应
光催化烯烃和一级杂芳基胺的反马氏氢胺化反应
光催化合成超高分子量聚合物
光催化剂种类
平行光化学反应仪
平行光反应仪实际应用
有机光催化
光催化制备醛
光化学反应仪多少钱
光催化烯烃的芳基烷基化反应
光加成反应原理
水光催化去芳构化[2+2]环加成反应
多位平行反应釜
高低温光催化反应器
光催化CH4
微通道反应器技术参数
光催化氧化糠醛
有机
多光源光化学反应仪
光催化实验
光反应器光源
实验室级光化学反应仪
光催化水氧化
光催化醛交叉偶联构建手性α-醇酮
光诱导水促进芳基烯烃C=C的歧化裂解
郑州光化学反应仪厂家
实验室多功能光化学反应仪
臭氧氧化
光催化合成镇痛药芬太尼
光反应釜用途
光催化气体烷烃与芳基溴的交叉偶联
高压光化学反应釜报价
可见光诱导构建非天然氨基酸
光催化剂选择
光化学反应仪波波长选择
光催化甲烷转化
光氯化反应釜
多光源光化学反应仪报价
光催化苄胺和烷基芳烃的C(sp3)−H芳基化反应
光催化交叉偶联构建烯丙胺
可见光还原交叉偶联
国产光化学反应仪
微通道反应器工作原理
光催化聚乙烯转化为乙烯和丙酸
光催化N-酰胺的α-三氟甲硫基化
二芳基二氢吩嗪基多孔有机聚合物
光催化医药合成反应仪
光催化降解磺胺甲恶唑抗生素
光催化芳基环丙烷和硝酮偶极环加成反应
光催化N-苯基哌啶的去饱和 β-C(sp3)–H酰胺化方法
光化学反应
光催化剂设计
光催化三氯甲基烯烃内酯化
二维富勒烯
清华大学
光催化环丙基酮去消旋化
多光源光化学反应仪厂家
电催化制备硒基噁唑酮衍生物
光诱导LMCT脱羧
可见光催化羰基类化合物
Angew
光催化二芳基醚分子转化为两个苯酚分子
光催化合成松香烷型二萜
可见光催化合成三环氮杂芳烃
光催化蒽醌基环三核铜配合物
光催化酰胺化反应
华东理工大学
光催化还原反应釜
可见光催化杂环C-H烷基化反应
光催化合成2-羟基苯并呋喃-3(2H)-酮
大连理工大学
可见光催化芳基环丙烷开环官能团化反应
UV光反应器波长
搅拌式光化学反应仪
光化学led光源波长
光催化原位生成芳基磺铵盐
可见光催化合成手性醇类化合物
微通道反应器的材质选择
光诱导加成实现螺桨烷双官能团化反应
光催化合成2,3-二氢苯并吡喃-4-酮并吡咯烷类化合物
光氧化还原实现消旋联烯与醛还原偶联反应
光催化微流体反应装置
微通道连续流反应器在医药生产中的应用
光催化合成合成烯丙基硼
光催化CO2还原
光催化烯基卤与α-硅胺的交叉偶联构建烯丙基叔胺
光催化构建全季碳羧酸化合物
光催化C-N偶联耦合产氢
光催化反应基本过程
光催化醇与氯代芳烃的脱氧交叉偶联反应
光催化氧化甲苯
实验室光化学反应仪
光催化剂实现单电子转移
光催化苯基甘氨酸
光催化制合成三氟甲基酮
光催化有机合成
有机光催化合成2-哌啶酮
光催化降解有机污染物
光催化丁二烯与吲哚的串联不对称去芳构化反应
光催化
光化学羰基自由基生成方法
光催化NHP酯合成手性烯丙基胺衍生物
光诱导交叉偶联
光催化烯丙基C-H键胺化构建支链胺
光催化氧化反应釜
双供体-受体有机网络光合成过氧化氢
光催化合成酯类化合物
光催化有机卤胺烷基化反应
光化学合成硫醚
玻璃微通道反应器
实验室光化学反应釜工作原理
光催化伯胺类化合物
光催化实现醛的α-叔烷基化
光催化制备氨基酸
光化学合成仪
光催化生物质多元醇制备乙二胺
紫外光化学反应仪厂家
光降解聚乙烯
朴玲钰
光催化聚乙烯
光催化合成亚磺酰胺
光催化连续流反应器
光催化串联反应
led光反应仪
光反应釜搅拌方式
单孔位全波段光反应仪
可见区光化学反应仪
单工位光化学反应仪
单工位光反应仪器
光催化构建α-CF3-炔
光微通道反应器
平行光反应仪选型
光诱导多组分分子内环化/羟基三氟甲基化级联反应
光化学反应仪光源选择
光化学反应釜报价
光催化合成氨基酯
紫外光反应仪
ghx光化学反应仪优势
光催化磺胺嘧啶
光催化水消毒
连续流光反应器设计原理
光催化LED光源
光催化乙烯基酮共轭加成
LED光反应仪
可见光催化有机硫去氯氢反应
光功能材料表征方法
光引发偶联反应
同济大学
光催化碳原子删除的色原酮二烯骨架编辑
光诱导钯催化体系
光化学反应仪选哪家
平行光反应仪维护
光催化交流研讨会
光催化尾气分解
光催化醇类化合物
光催化降解CIP
X射线光化学反应仪
光电催化硝酸盐还原产氨
光催化烯烃合成β-氨基酸衍生物
光驱动三元催化脂肪胺γ-C−H键转化
光环化反应
光诱导下双核Au催化偕二氯代化合物多样化硼化修饰
高精密光化学反应仪厂家
可见光催化醛和铵盐合成腈类化合物
光化学反应仪操作指南
光催化合成α-酮酯
光催化光源波长选型
寡聚物
光催化芳基氯化物与醇类合成硫醚
光化学反应仪进口风险
武汉光化学反应仪
流动化学光反应器
光化学反应仪精度
光催化烯醇硅醚的α-磺酰化反应
光降解抗生素
可见光催化呋喃转化成吡咯化合物
烯二炔的环化
光化学反应仪怎么选择
光催化丁二烯的不对称胺化
光催化5-羟甲基糠醛
光反应仪统一调光
光催化水净化器
光化学反应仪化工领域应用
有机光催化剂功能区别
光催化合成苯甲酸
石英光反应釜
光催化不对称还原交叉偶联
连续流微通道光反应器
光诱导烯烃氮杂环丙烷化反应
可见光微通道反应器
微通道光反应器
光催化合成N-烷基苯胺
大连工业大学
光化学反应仪哪家性价比高
北京大学
光催化生成乙烯
光流体微通道反应器参数
合成气和烯丙基sp3 C–H键的选择性芳基化/烷基化
光催化析氢耦合苯甲醇氧化
光催化合成C4化合物
固定床光反应器
光催化不饱和烃
深紫外光化学反应仪厂家
光催化芳烃对位选择性C-H键胺化新策略
马来酰亚胺
光子自旋轨道耦合
光促铜催化脱羧卤磺酰化反应
光催化构建环丙烷化合物
光催化合成吡唑硼化物
光化学反应仪功率
光催化药物降解
光化学反应仪说明书
光催化富电子芳烃的碳-杂原子偶联
光氧化合成
光化学反应优势
光催化胺烷基化
光催化制二芳基硅化物
红外光化学反应仪
光催化降解酚类物质
氮化硼
光反应釜报价
光催化反应釜工作原理
光催化去消旋化反应
光催化降解水中四环素类抗生素
Au-CeO2
光异构化
光催化去除四环素
光化学反应仪解决方案
光催化甲苯制苯甲醛
光催化氧化衍生醇
光催化生物质脱氢
光催化氧化甲烷
光异构化反应
光催化还原法
光化学反应釜技术参数
光催化氧化糠醛制备四氯化碳化合物
光催化基本原理
光反应仪
分子光谱学概念
溴二氟烷基
UV光化学反应仪
光化学反应仪搅拌方式
酶启发配位聚合物超分子酸构筑
光催化构建芳基烷烃
光氧化
光催化环加成反应构建碳环
光催化合成C₂H₆
光催化[2+2]环加成反应
光化学反应仪价格
连续流光反应器
深紫外光催化反应器
石英通道连续流反应器
光化学反应仪实验结果
光催化芳基烯烃C=C键的歧化裂解
光催化合成磺酰胺
光催化降解仪器
贵州大学
光流体微通道反应器厂家
可见光催化螺碳环化合物的解构氟化反应
光催化合成芳胺
光催化降解家禽粪便厌氧消化液中有机污染物
可见光催化氧化烷烃
光还原反应
光化学反应机理
光化学反应仪设备
光催化醛不对称形式交叉偶联
新加坡国立大学
二苯乙烯光异构化
烯丙基sp3 C–H键的选择性芳基化
光催化构建芳杂胺
光催化糖类转化制备5-羟甲基糠醛
光催化脱硫反应釜
高通量光反应仪选型
可见光催化不对称烯丙基烷基化反应
微通道反应器压力值设计
光催化双分子烯烃还原偶联
光催化合成手性双环己烷类化合物
光催化domino反应构建硫杂环丁烷
光催化氧化法
光催化醚的脱氧交叉偶联
光催化CO2还原制乙醇
光催化助力烯丙基C-H键胺化
光催化合成氮杂环丁烷化合物
可见光化学反应仪
光催化环己酮脱酰芳基化
釜式光反应器厂商
连续流光反应器
三氟甲基硫代化反应
β-内酰胺
光氧化还原-NHC
光化学合成应用
光催化芳烃直接胺化
光催化甲烷制乙烷
可见光催化降解黄药
光催化甲烷制乙醇
光催化苯甲酸酯与烯丙醇的脱氧交叉偶联
光降解反应釜应用场景
光反应仪器选型
光化学合成氮杂环庚烷
光催化aza Paternò–Büchi反应构建氮杂环丁烷
光催化合成应用
光催化降解技术
光催化氧化甲烷制甲醇
光氧化还原催化芳香醚氢解
武汉光化学反应仪价格
光催化产氢装置
光降解反应釜
光催化芳烃的氟磺酰甲基化
光诱导催化构建Z-烯烃
光加成反应
光酶选择性自由基环化
光催化水分解产氢
光化学反应仪功能
光电催化二氧化碳还原产甲醇
光催化合成三氟甲基酮
哈尔滨工业大学
光诱导下偶氮官能化合成吲唑
光催化合成原理
光催化合成氮杂环丁烷
天津光化学反应仪厂家
光催化氧化硫醇制备二硫醚
光催化芳构化驱动C-C键断裂的交叉偶联
光催化芳香醚氢解
光催化乙酸偶联生产丁二酸
光谱学技术化学反应机理研究
可见光诱导合成杂芳基碳-糖苷
光催化烷基C-H键选择性末端硼化转化
光催化降解聚对苯二甲酸乙二醇酯塑料
超分子光-酶偶联催化水污染物绿色降解
光催化1,2-氨基醇合成
光催化γ-氨基官能化修饰
光催化药物合成
光流体微通道反应器小试
可见光催化
多试管光化学反应仪价格
光催化分解水制氢
光催化反应原理
常州光化学反应仪
光催化合成多官能团34-二氢喹唑烷酮
光化学反应仪光学系统
高精密光化学反应仪报价
会聚对电解-光催化策略
光催化乙烷氧气脱氢制乙烯
羧化反应
郑州光化学反应仪
光催化水分解
玻璃光催化反应釜工作原理
光诱导合成瓶刷聚合物
光诱导Pd催化丁二烯与吲哚的串联不对称去芳构化反应
芳烃的光氧化
光化学合成有机化合物
浙江大学
地屈孕酮制备设备
光催化甲烷氧化
紫外可见光化学反应仪
光氧化还原催化丙烯酸酯
连续流反应器
光催化制α‑叔伯胺
光催化氧化降解盐酸四环素
实验平行光反应仪
光化学反应仪市场
led光催化反应设备
光催化降解
微反应器
天津大学雷圣宾教授课题组
光催化降解甲硝唑
光催化CO促进羰基化
国内光化学反应仪
有机光催化剂应用领域
光催化糖类
光化学有机反应
光催化三氟乙酸对芳烃的三氟甲基化
釜式光反应器厂家
光催化合成乙烷
高压光反应釜
多位光化学反应仪
光化学反应仪光源分类
光还原催化乙烯和CO₂合成可光降解聚乙烯
光催化技术
6工位光化学反应仪
光诱导炔烃双官能团化反应
光催化苯甲醚类化合物
可见光诱导有机膦促进磺酰肟盐的连续脱氧
烯烃的光氧化
光催化C-H官能团化实现吲哚的不对称去芳构化
光诱导催化sp3C−H键卤代
光催化制醇类化合物
bromide
光催化丁二烯
光催化甲烷氧化制甲醇
偶联
上海光化学反应仪
光催化反应仪器选型
南开大学
光催化非活化烯丙醇的半频哪醇重排反应
光催化脂肪族羧酸脱羧卤代
光化学反应仪配套设备
香港大学
大容量光化学反应仪厂家
微通道反应器持液量
常州光化学反应仪价格
光催化BCBs酰胺的烷基芳基化反应
紫外光化学反应仪波长
丙酮光催化脱氢偶联制备2,5-己二酮
光催化烷烃C–H键固SO2构建砜
光催化反应器在有机合成领域的应用
光诱导草酸生成二氧化碳自由基阴离子
光催化制氢产率
常温常压光解塑料
光诱导脱硫交叉偶联
电化学
光催化乙烷
光催化酰胺BCBs与α-羰基烷基溴的自由基加成反应
有机磺酸
紫外单孔光反应仪
光溴化反应釜
光流体微反应器报价
光催化污水处理
甲苯光催化氧化制苯甲醛
光催化乙炔制备氯乙烯
光催化氧化降解抗生素
光催化有机合成钛磺酸框架
光催化对四溴双酚A
复合光催化剂
光化学反应仪使用说明
微通道反应器作用
光催化促进亚磺酰胺合成
光诱导紫苏迷迭香酸生物合成
连续流微通道反应器
光催化木质素模型化合物
马来酰亚胺衍生物
常温光化学反应仪
组合式反应釜
可见光催化伯胺类化合物
光催化氧化还原反应制备香料中间体
光催化反应釜作用
光催化乙炔氢氯化反应方法
光催化制氨基酸
华南理工大学
可见光诱导双核金催化脱卤硼化
光催化烷氧羰基保护仲胺的α-烷基化
氢烯基化
光诱导脱羧烷基化反应
光催化接力不对称催化
科研级光催化反应器
光催化医药合成反应釜
第23届有机合成国际会议
光催化苯甲醚
光诱导铜催化脱羧 C-C偶联
液冷光化学反应仪
光催化制氢反应仪
光催化构建支链烷基胺
光电催化醇的C-C键断裂转化
可见光催化氧化伯、仲苄基 C(sp3)-H 键的亲核胺化
光偶联反应方程式
光化学led光源
光催化合成酮类化合物
铀酰光催化烯烃氧化裂解
光催化唑类N-H与烯烃的氢胺化反应
光催化二甲醚
光溴化反应
光催化分解反应
单工位LED光反应器
单工位全波段光反应仪
多位光化学反应仪报价
东京大学
光催化反应釜操作指南
有机光催化剂分类
柱式微通道反应器
光诱导构建硫代酰胺
阿德莱德大学
光氧化还原催化构建C-苷
自由基还原交叉偶联
水凝胶
芳香族异硫氰酸酯
光催化制备硫醇
上海光化学反应仪厂家排名
多试管光化学反应仪厂家
Science
脂肪族异硫氰酸酯
中国科学技术大学
光诱导烯基重氮[4+2]环加成反应
光催化合成环丁烷氧化吲哚骨架
光催化去除有机污染物
生产级连续流光反应器
光催化反应器使用注意事项
光催化合成维生素B工艺流程
可见光催化构建苯并环丁醇
氟聚合物
普林斯顿大学
国产光化学反应仪厂家
盘管连续流反应器
可见光光氧化还原
石英光化学反应釜
山东大学
光催化BCBs烷基芳基化反应
光催化配套设备
光催化降解聚乙烯
光偶联反应原理
实验室光催化反应釜
光催化氧化
光催化构建环状内酯衍生物
光催化合成甲酸苯酯类化合物
钙钛矿光催化剂
微通道连续流反应器
双原子催化CO2光合成C2H4
光催化合成稠多环邻氨基醇类化合物
溶胶凝胶法合成光催化剂
光催化反应机理
光催化合成轴手性N-芳基吡咯
ghx光化学反应仪
光电催化芳烃的脱羧三氟甲基化
前景
UV光反应器
光氧化反应
光催化合成BCP醚类衍生物
可见光诱导甲酸盐还原脱卤环化合成吲哚酮类化合物
氨基悬链烯烃
光化学反应仪工作原理
光催化甲苯氧化
光电共催化
光催化制备5-羟甲基糠醛
光催化反应釜光源
实验室光反应釜
光催化苯胺和DIPEA的偶联反应
光催化合成反应釜
可见光光源
光致异构化合成应用
可见光诱导下氮杂尿嘧啶的C−H硅基化反应
微通道光催化反应器




