【Org. Lett.】重文理屈川华团队:可见光诱导“碳”插入,让吡咯环库“一键扩容”

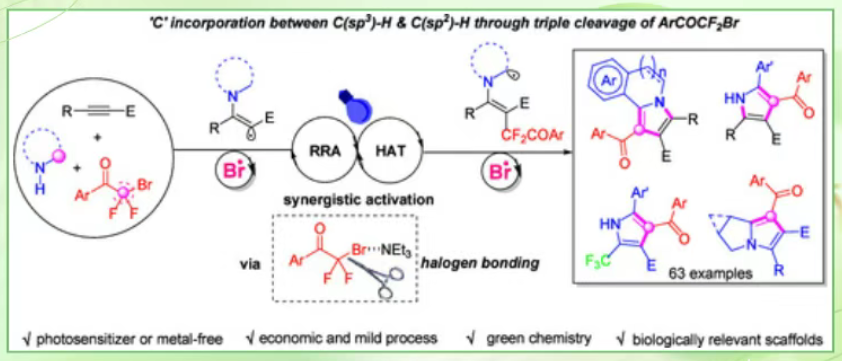
在药物化学家眼里,吡咯环是当之无愧的“特权结构”:从抗癌明星舒尼替尼到抗菌天然产物Lamellarin,五元氮环几乎无处不在。传统方法(Paal-Knorr、Barton-Zard、交叉偶联)常需预官能团化底物,当量氧化剂或贵金属,高温/强碱。高度取代、稠环或含氟吡咯的“绿色”、“多样性”构建仍是方法学空白。烯胺的氮插入反应已被广泛报道,但碳插入却鲜有实现。在此,重庆文理学院屈川华、宋桂廷团队联合澳门理工大学严潇教授反其道而行,让ArCOCF₂Br在卤键作用下释放溴自由基,同时扮演HAT“拔氢者”与RRA“可逆加成者”的双重角色,先后激活烯胺的sp²-与sp³- C–H键,最终把CF₂COAr片段整体“塞”进环内,完成前所未有的三重断裂(C–Br/C–F/C–H),一步给出稠合或高度修饰的吡咯。该方法无需金属、光敏剂或外加氧化剂,仅三乙胺作卤键受体、10 W蓝光照射48小时,即可将廉价易得的胺、炔与ArCOCF₂Br三组分“拼”成吡咯库。本文带您拆解其机理精妙之处与药物化学潜力。
策略创新:溴自由基“HAT + RRA”双线程机制
研究团队利用ArCOCF₂Br作为双重自由基前体,在可见光照射下,通过卤键(XB)与三乙胺形成复合物,诱导C(sp³)–Br键均裂,产生溴自由基(Br•)和二氟烷基自由基(ArCOCF₂•),其中,Br•不再只是简单的卤素自由基,而是承担了双重角色:

最终,两个自由基(烯胺自由基 + ArCOCF₂•)发生交叉偶联,并通过脱氟/脱质子/芳构化完成吡咯环的构建。这是首次将溴自由基的HAT与RRA过程整合于单一底物,实现“C-插入”而非传统的“N-插入”。
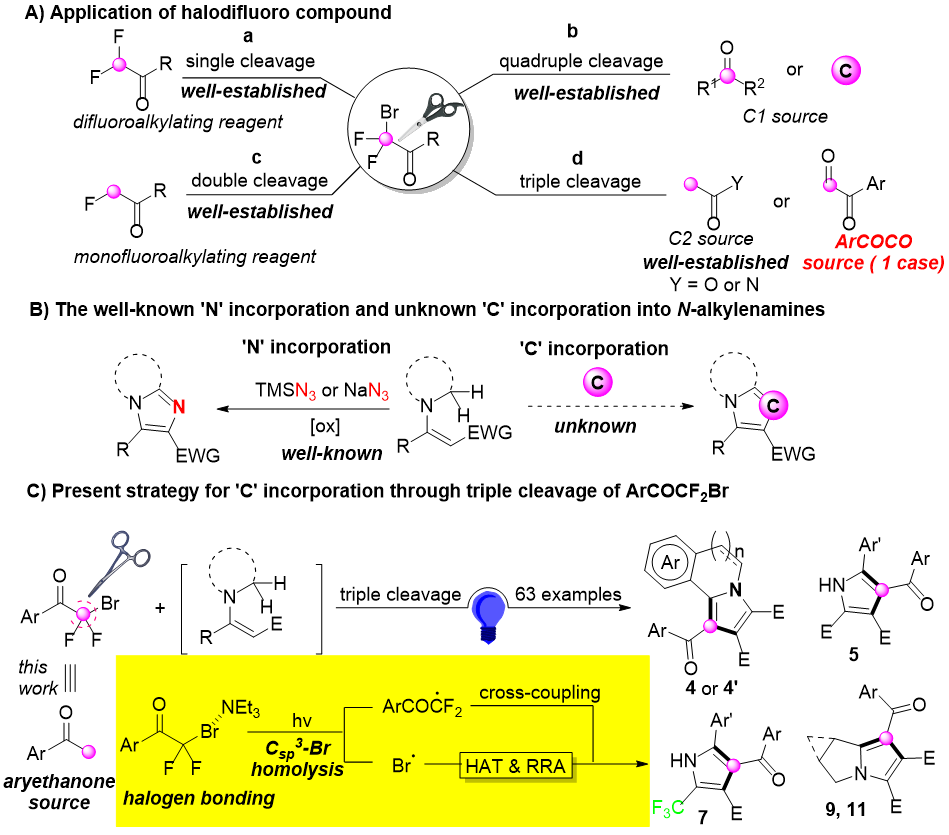
图1:从“N-插入”到“C-插入”的合成策略(来源:Org. Lett.)
优化显示,三种试剂(胺 + 炔 + ArCOCF₂Br)→ 一盏蓝光(λmax 454 nm)→ 48 h,三乙胺当“开关”,金属、光敏剂、氧化剂?统统不需要!在确定了最佳条件后,作者接下来评估了α-溴二氟酰基芳烃、胺、炔烃和CF3取代的N-苄基胺的底物范围(图2-4)。以中等至优异的收率获得了极其广泛的吡咯衍生物,溴自由基对胺和芳基部分之间的C(sp³)–H键表现出卓越的HAT选择性。值得注意的是,其他活化的C(sp³)–H键,包括那些α-氮、氧、硫和苄基的位置,在溴自由基诱导的HAT制度下保持完全完整,这突出了该策略的优异区域选择性。
经考察底物范围非常广:胺源:环状(四氢异喹啉、吲哚啉)、开链(苄胺、杂芳甲胺)乃至CF₃-取代烯胺全部兼容;炔源:乙炔二羧酸酯、三氟丁炔酸酯均可顺利环化;芳酰溴:给/吸电子基、杂芳酮均不影响收率。特别地,吲哚衍生底物可自发或DDQ辅助脱氢,直接得到全芳香indolizinoindole,为天然产物全合成提供捷径。

图2:环状苄胺及不同芳酰溴的碳插入环化(来源:Org. Lett.)
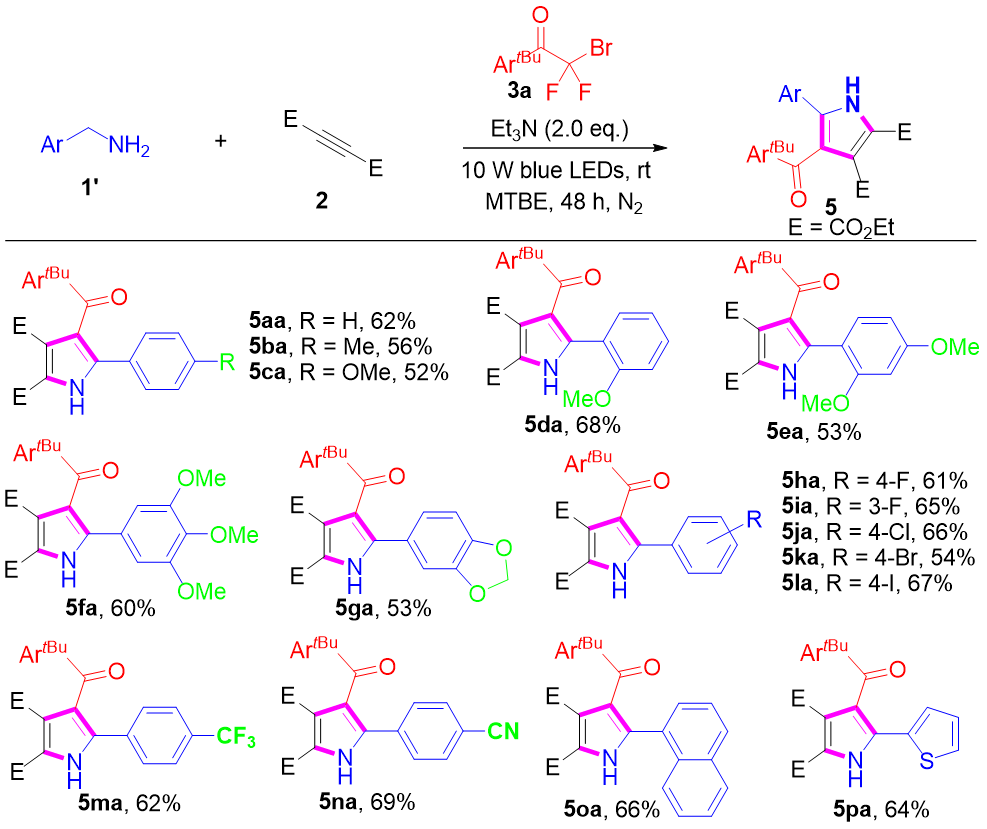
图3:开链苄胺的碳插入环化(来源:Org. Lett.)
重要的是,开链苄胺在该三组分偶联/环化反应中也表现出良好的反应活性,能够以中等产率得到高度取代的吡咯产物(5aa−5pa)(见图3)。这些苄胺对多种官能团具有良好的耐受性,包括富电子基团以及缺电子基团。为了增加分子骨架的结构多样性,我们将该反应体系扩展至三氟甲基取代的烯胺,结果以较高的产率(79−90%)得到了相应的CF₃功能化吡咯衍生物(7aa−7ma),并表现出优异的官能团兼容性(见图4)。CF₃取代的杂环结构在有机材料、药物、农药以及正电子发射断层扫描(PET)示踪剂中具有重要应用价值,这归因于其强吸电子特性、较高的脂溶性以及优异的代谢稳定性。
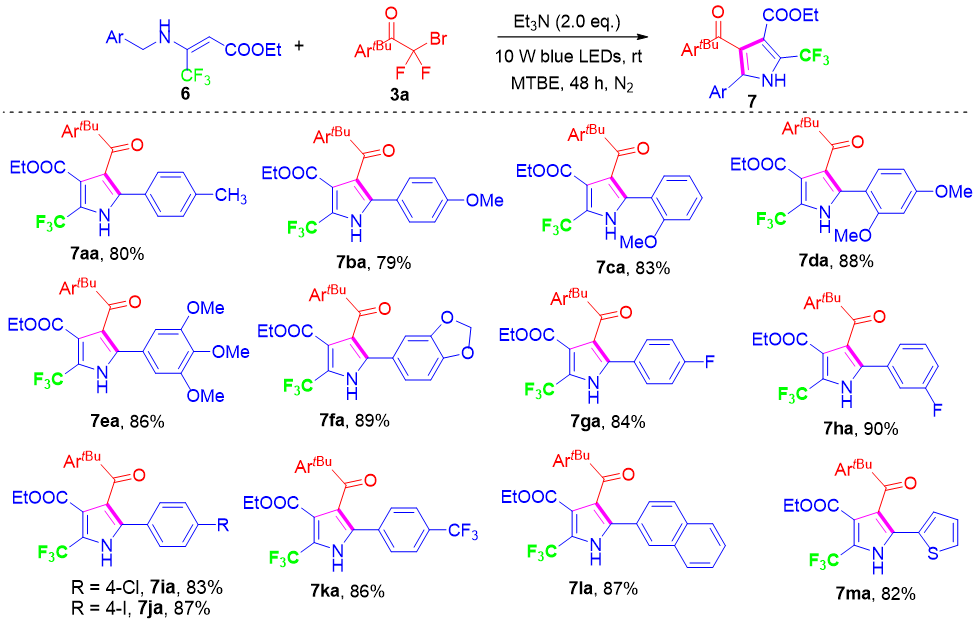
图4:CF3取代烯胺的碳插入环化(来源:Org. Lett.)
0.86 g规模反应收率仍保持91%,证明工艺稳健;烷基环胺也适用该反应,证明了该策略的广泛的底物范围;产物NH基团与邻芳C–H可进一步Ru-催化氧化环化,两步构建含CF₃的pyrrolo[2,1-a]isoquinoline,收率高达93%,为后续结构多样化与活性筛选打开空间(图5)。
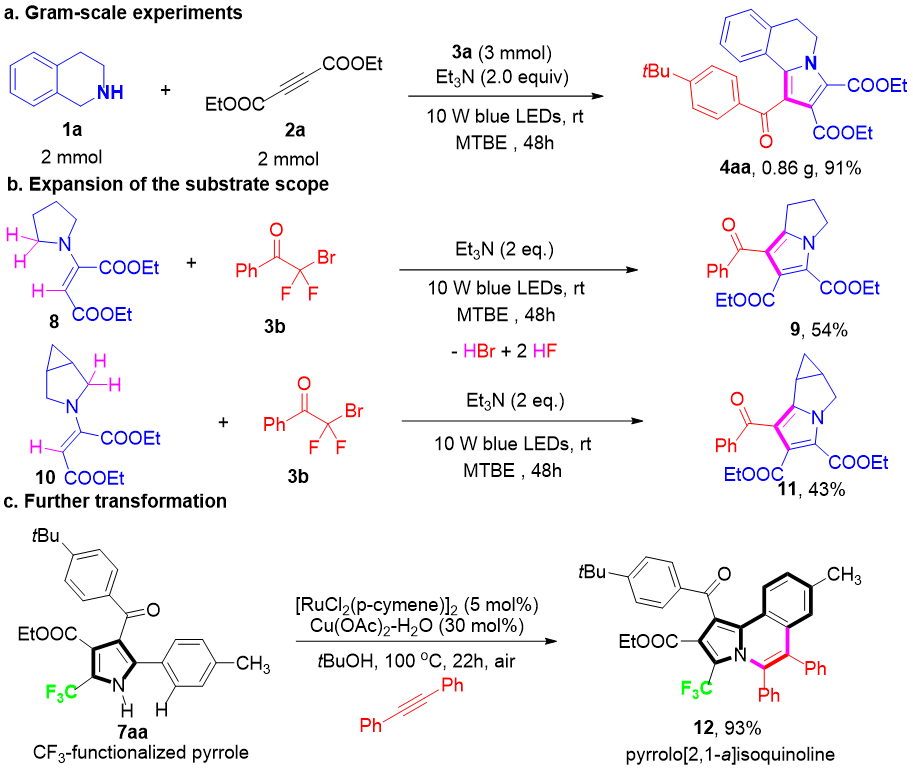
图5:克级示范与后续衍生(来源:Org. Lett.)
作者经过一系列对照和控制实验(图6),证实了烯胺自由基中间体在反应中起着关键作用。例如,四氢喹啉13a在标准条件下反应得到了C–H偶联产物14a,这表明溴自由基介导的RRA(可逆自由基加成)在该转化中起到了关键作用。此外,作者未检测到二氟烷基自由基与通过溴自由基介导的氢原子转移(HAT)生成的α-氨基烷基自由基之间的偶联产物。一系列自由基淬灭实验证实了烯胺自由基作为反应中间体的存在。在含有四氢异喹啉的多组分反应的淬灭实验,检测到了脱氟中间体18和烯胺-TEMPO加合物19,为“C”插入前体18是由二氟烷基自由基与烯胺自由基偶联后脱氟生成的提供了直接证据。光谱和¹³C-NMR实验结果揭示了三乙胺与溴二氟化合物之间形成了卤键复合物,而量子产率测定(Φ < 1)排除了该反应为自由基链式路径。
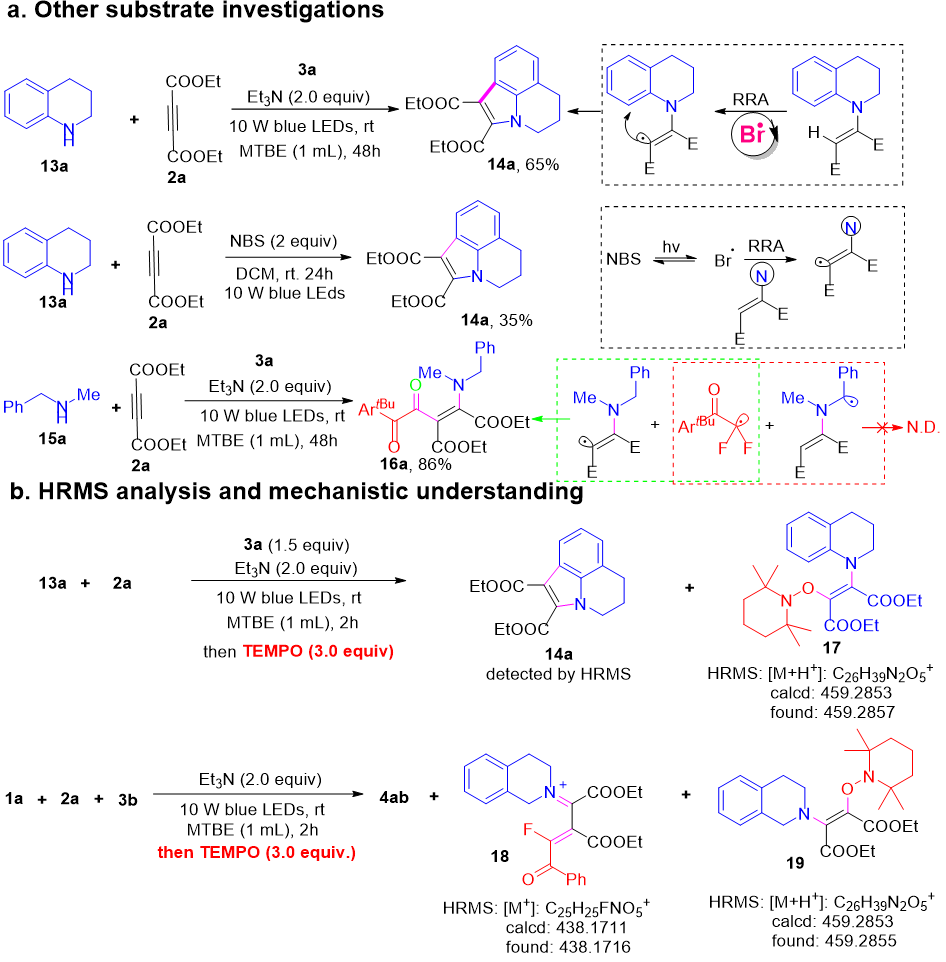
图6:机理研究(来源:Org. Lett.)
基于上述实验,作者提出如图7所示的合理机理。三乙胺与二氟溴代芳基酮3首先形成卤键(XB)复合物21,该复合物在可见光照射下发生C(sp³)–Br键均裂,生成二氟烷基自由基22与溴自由基。随后,亲电性的溴自由基加成到富电子的烯胺20(由 THIQ 1a与丁炔二酸二乙酯2a经快速亲核加成生成)上,得到自由基23。23与另一分子溴自由基发生氢原子转移(HAT),再经光诱导C(sp²)–Br键均裂,释放出烯胺自由基25并再生溴自由基。在此过程中,溴自由基通过可逆地加成到20的烯烃部分,充当“催化剂”角色,将烯胺活化为烯胺自由基 25;该自由基随后与二氟烷基自由基 22 偶联,生成中间体 26。烯胺β-碳上的CF₂单元因相邻氮孤对电子的影响而不稳定,促进C–F键断裂,得到中间体18。接着,溴自由基再次介导 HAT,生成亲核性的α-氨基烷基自由基;该自由基对缺电子烯烃27发生Giese加成,形成亲电自由基 28。极性匹配的HAT由富电子的Et₃N或MTB 向28提供氢原子,得到中间体29;后者在碱性条件下经E2cb机制脱去HF与质子,最终重建芳香性吡咯环,生成产物 ——芳香环的重建被认为是整个反应的驱动力。另一方面,由苄胺衍生的烯胺与 α-溴二氟代芳基酮按上述类似过程可得到产物5与7。
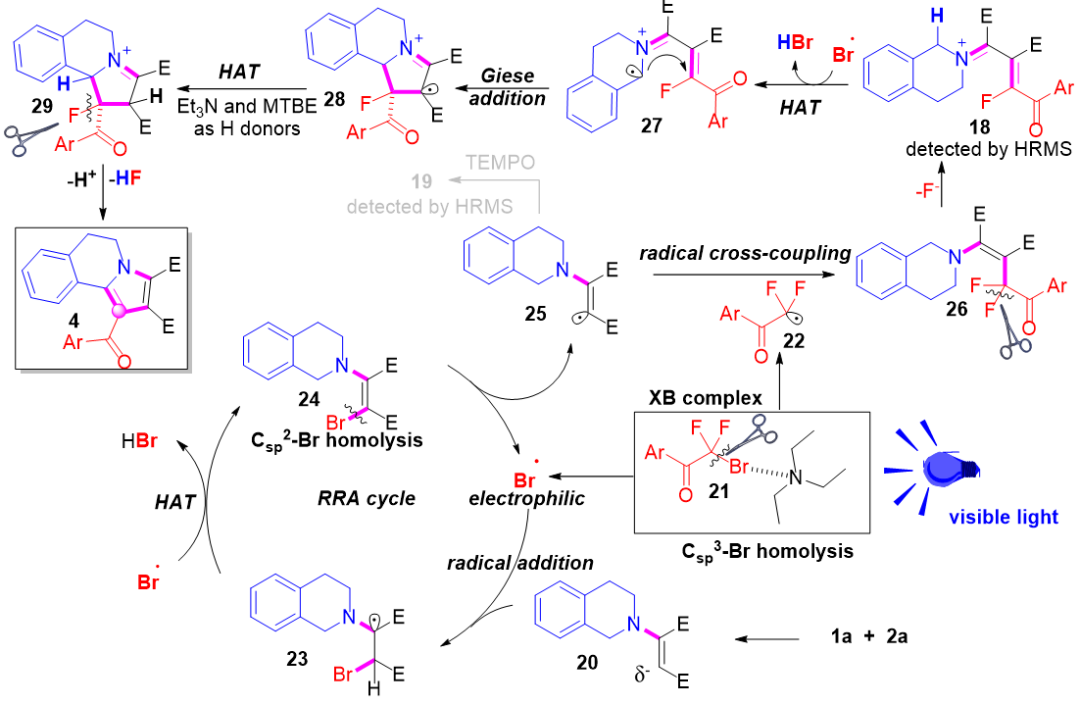
图7:反应历程(来源:Org. Lett.)
综上所述,这项研究不仅在自由基化学和杂环合成领域树立了新标杆,更为药物先导化合物的快速发现提供了绿色、高效、可扩展的新工具。随着流动化学、AI设计、自动化合成的深度融合,我们有理由相信,这一“C-插入”策略将成为未来天然产物全合成、药物分子构建和绿色工艺开发的核心技术之一。与此同时,这项研究也在机理上首次实现了溴自由基HAT/RRA双线程协同,更在合成应用上提供了一种绿色、高效、广谱、可放大的吡咯构建新策略。它将为药物先导化合物的快速发现、天然产物的简洁全合成以及绿色工艺开发提供强有力的工具。
论文信息:
Synthesis of Densely Functionalized Pyrroles via Photoinduced C-Insertion into N-Alkylenamines: Sequential C(sp2)–H/C(sp3)–H Activation with Bromine Radicals
Chuan-Hua Qu,* Su-Ya Liu, Shan-Shan Chen, Nian Wang, Ying Cheng, Shi-You Xue, Xue-Ying Yang, Wen-Bin Zong, Yuan Zhou, Li-Min Zhang, Xiang-Yi Zeng, Qin-Mao Li, Lan-Bin He, Xiao Yan,* Gui-Ting Song*
Org. Lett. 2025, 27, 40, 11264.
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




