【J. Med. Chem.】南师大苏志教授团队:乏氧环境下靶向光氧化还原系统激活光动力免疫疗法

光动力疗法(PDT)是一种利用光敏剂(PS)在光照下产生活性氧(ROS)杀灭肿瘤细胞的治疗手段。与传统疗法相比,PDT的优势在于精准递送且副作用极小。迄今为止,大多数有机光敏剂均为依赖氧气的II型光敏剂,其能量传递途径可产生单线性氧(1O2)。实体瘤因异常增殖速率消耗氧气而呈现极端乏氧特征,PDT过程中氧气消耗进一步加剧乏氧状态,导致治疗预后不良,因此II型PS的PDT疗效受到严重限制。相比之下,I型光敏剂通过三重态3PS*与邻近底物或分子氧间的电子转移过程,产生超氧阴离子(O2−•)和羟基自由基(•OH),对氧依赖性较低,能有效缓解乏氧肿瘤微环境。然而目前仍缺乏通用I型光敏剂的设计策略。
环金属化铱(III)片段作为常见的光敏单元,已在二氧化碳光还原研究中得到广泛应用。然而,由于其吸收波长较短(峰值约280 nm)且穿透能力较弱,环金属化铱(III)光敏剂在癌症光动力治疗中的应用受到限制。近日,南京师范大学苏志教授团队基于其在环金属铱光敏剂领域的前期工作(Chem. Eng. J. 2024, 497, 155022),开发了一种能隙调控的I型光敏剂设计策略,证明了合理结构设计在癌症治疗中的重要性。相关成果近期在J. Med. Chem.(DOI: 10.1021/acs.jmedchem.5c01579)上发表。
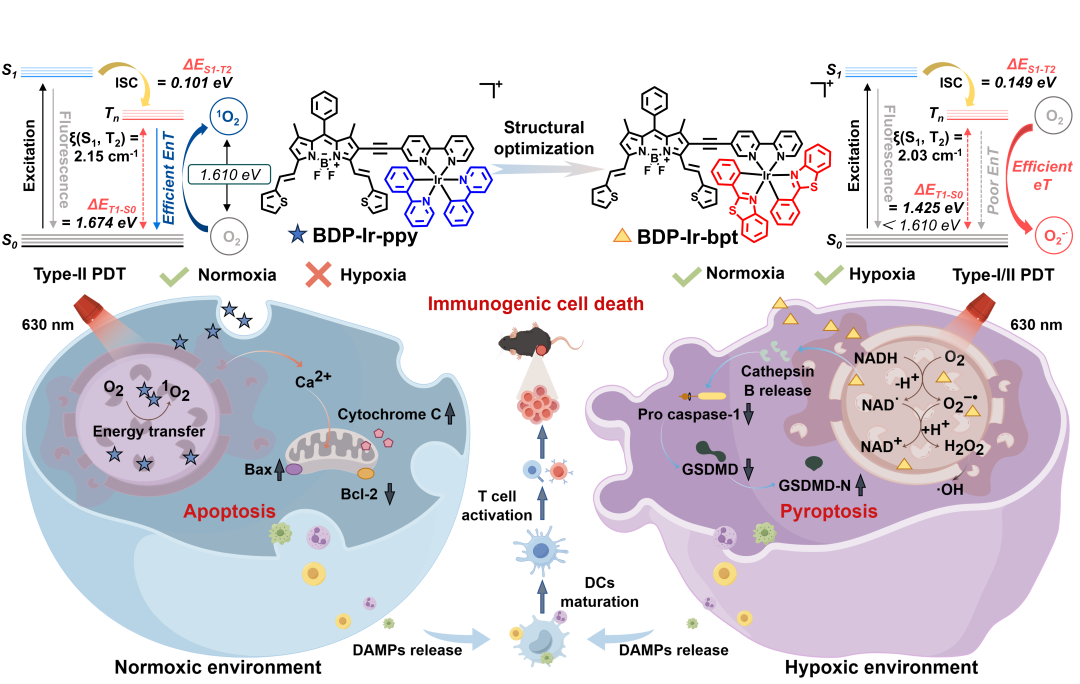
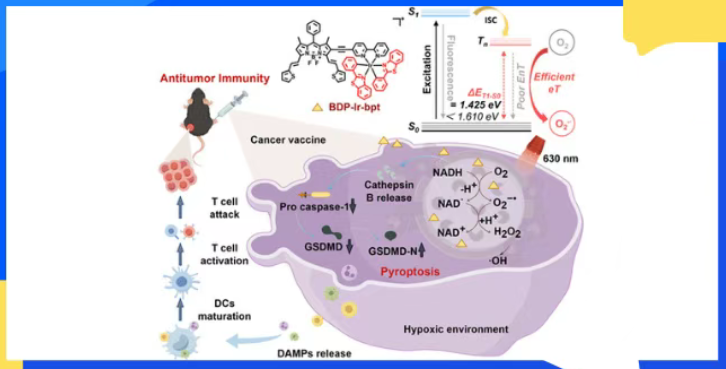
图1 BDP-Ir-bpt作为I型光敏剂在光动力免疫治疗中的作用机制。(图源:J. Med. Chem.)
为实现II型PS向I型PS的转变,作者首先在B3LYP/6−31G(d,p)/LANL2DZ水平下进行了时间依赖密度泛函理论(TDDFT)计算,将辅助C^N配体的2-苯基吡啶(ppy)替换为2-苯基苯并[d]噻唑(bpt),所得光敏剂BDP-Ir-bpt可将ΔET1-S0最小化至1.425 eV,引发了高效的电子转移,激活了O2向O2−•的转化。
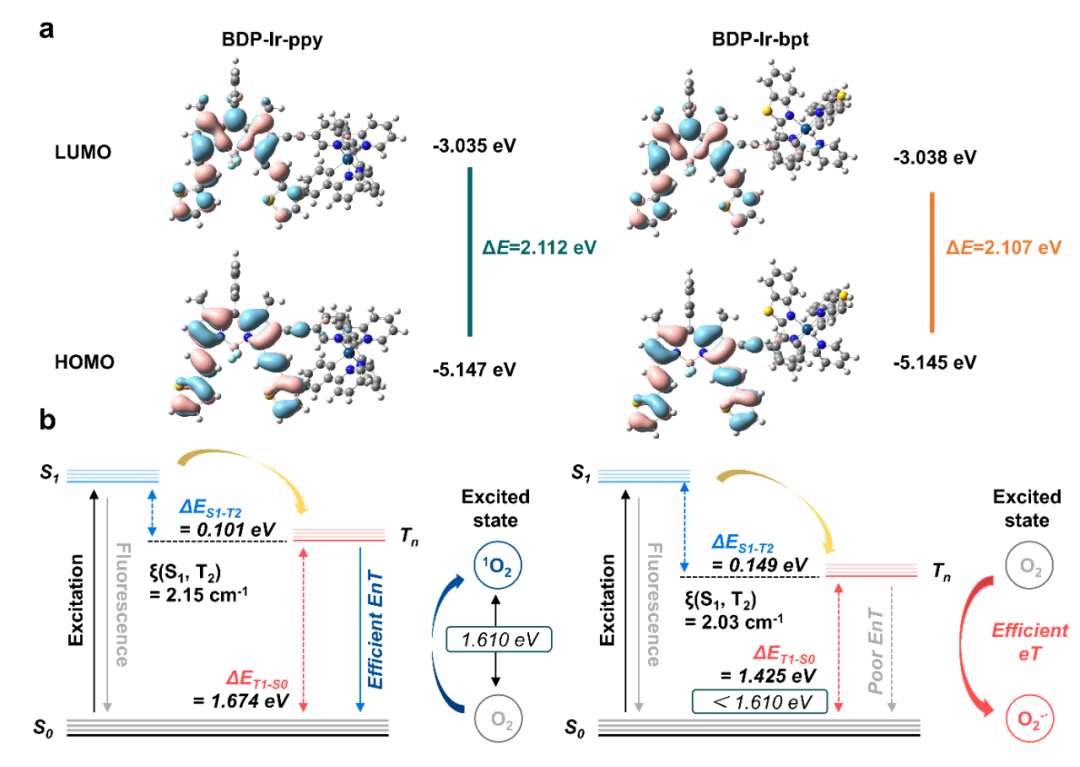
图2 BDP-Ir-ppy与BDP-Ir-bpt的理论计算结果。(图源:J. Med. Chem.)
在630 nm波长(0.6 W cm-2、5 min)照射下,在常氧(21% O2)和乏氧(1% O2)环境下,BDP-Ir-bpt均能对A549细胞展现杀伤效果(IC50 < 2 μM),而BDP-Ir-ppy的效果在乏氧条件下受到抑制。由于BDP-Ir-bpt在光照下可诱导细胞内产生大量ROS,细胞线粒体功能显著受抑(图3)。由于BDP-Ir-bpt在A549细胞的溶酶体内富集,在照射下,溶酶体膜破裂,溶酶体完整性受损,从而导致蛋白质大量泄漏到细胞质中。溶酶体破裂导致的组织蛋白酶B(CTSB)渗漏会激活NLRP3炎症小体,而诱导GSDMD依赖性焦亡,并促进白细胞介素IL-1β和IL-18的释放,这些物质共同参与先天免疫防御和稳态维持。
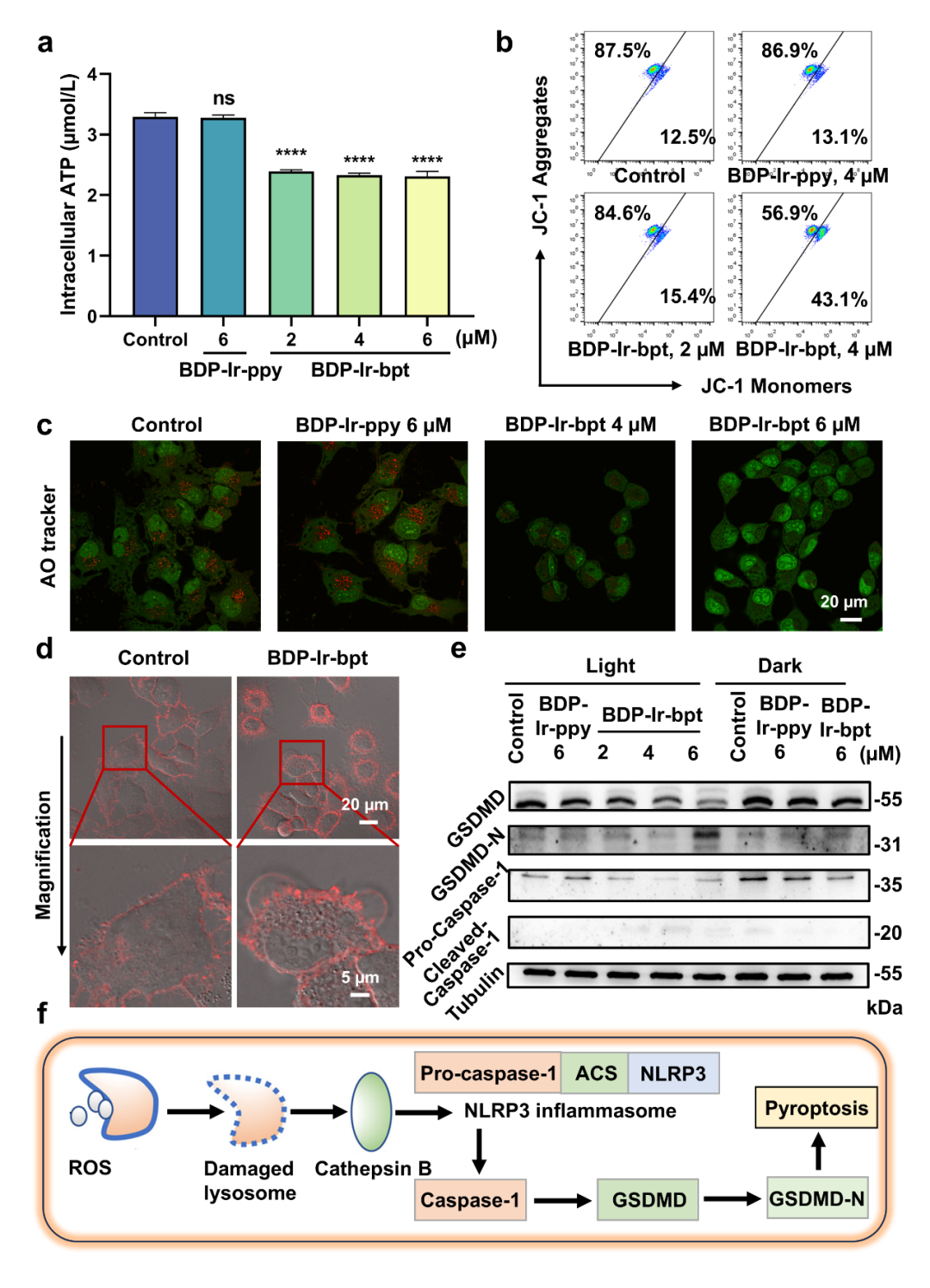
图3 细胞内细胞器损伤及焦亡情况。(图源:J. Med. Chem.)
通过建立预防模型进一步评估了BDP-Ir-bpt在光照下的体内抗癌免疫反应(图4)。结果显示BDP-Ir-bpt+光照组的小鼠肿瘤显著抑制,抑瘤率高达74%。树突状细胞(DC)成熟标志物的CD86和CD80阳性细胞, CD8+和CD4+ T细胞,促炎细胞因子IL-18、IL-1β和TNFα的表达水平都显著提高,同时降低了抗炎细胞因子IL-10的水平。上述结果证实,BDP-Ir-bpt在照射条件下能有效激活体内抗肿瘤免疫反应并抑制肿瘤生长。
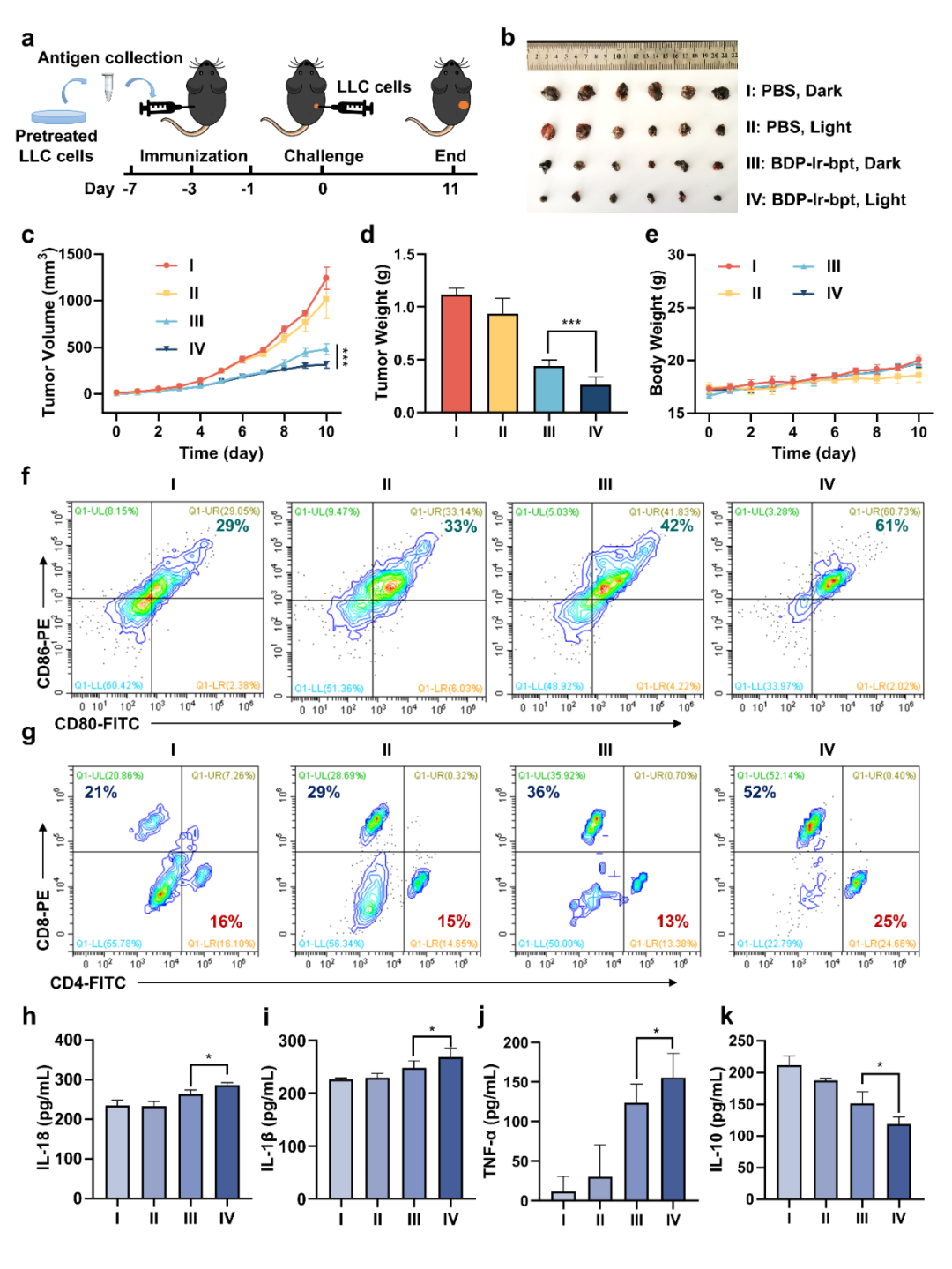
图4 抗肿瘤免疫实验。(图源:J. Med. Chem.)
综上所述,苏志教授团队在理论研究的指导下,采用2-苯基苯并[d]噻唑配体替代2-苯基吡啶配体,最终获得了I型光敏剂BDP-Ir-bpt。三重态-基态能隙从1.674 eV降至1.425 eV,这限制了从3O2到1O2的能量传递,并启动了从O2到O2−•的电子传递,成功将II型光敏剂转化为I型光敏剂,从而缓解了乏氧肿瘤微环境。BDP-Ir-bpt能有效诱导程序性细胞死亡并抑制实体瘤生长。本研究不仅提供了缓解缺氧微环境、启动光动力免疫治疗的生物相容性光敏剂,更揭示了合理结构设计在癌症治疗中的重要性。
该研究工作得到了国家自然科学基金(22277056,22407061)、江苏省杰出青年基金(BK20230006)、江苏省自然科学基金(BK20231090,BK20230977)、江苏省高等学校自然科学基金(23KJB150020)、江苏省学位与研究生教育改革项目(JGKT24_C028)和江苏省研究生科研实践创新项目(SJCX240629)的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




