【Chin. J. Chem.】吴晶晶/鲍晓光团队:光氧化还原催化烷基羧酸的脱羧胺化反应研究

胺及其他含氮官能团非常重要,可见于许多具有生物活性的生物碱、小分子药物和农用化学品中。因此,在小分子特别是天然产物中,后期引入胺取代基在药物化学中具有极高价值。近年来,随着可见光光氧化还原催化的巨大发展,自由基胺化因其条件温和和优异的官能团兼容性而备受关注。受Studer, Cho和Glorius工作的启发,吴晶晶课题组开发了一种亚胺型氮中心自由基捕获剂,并成功将该试剂应用于光氧化还原催化的烷基硼酸酯的自由基胺化反应。考虑到羧酸是许多天然产物和药物分子中的常见官能团,发展后期脱羧胺化方法可以为相关化合物的生物活性研究快速提胺化衍生物样品,因此作者拟将先前发展的试剂用于该脱羧胺化反应。
对于脱羧胺化反应,已有几种直接脱羧C–N偶联的报道,其中大多数使用氮中心自由基捕获剂。此外,铜或铁催化的直接脱羧胺化反应也有研究。从一些预活化羧酸进行脱羧胺化的策略也有报道,包括预活化为酰基叠氮化物用于Curtius重排;预活化为碘代羧酸盐或氧化还原活性酯用于单电子转移(SET)活化。近年来,Cho课题组通过将羧酸预活化为肟酯,利用光诱导的三重态能量转移(EnT)策略,开发了一种脱羧胺化反应。尽管这些方法已成功应用于脱羧C–N偶联,但仍存在一些局限性:1.与叠氮化物相关的安全问题影响了Curtius重排或脱羧叠氮化反应的应用;2.对于预活化策略,每个底物都需要额外的预活化步骤,缺乏步骤经济性和整体原子经济性;3.双光氧化还原铜催化策略和三重态EnT策略都需要使用至少一种过渡金属催化剂。为了解决这些局限性,吴晶晶课题组开发一种光氧化还原催化的烷基羧酸直接脱羧胺化反应(图1)。
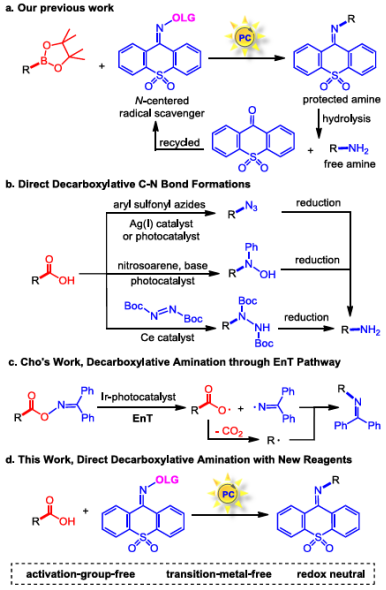
图1. 自由基C-N偶联策略、氮中心自由基捕获剂与脱羧胺化方法(图源:Chin. J. Chem.)
通过筛选不同的亚胺型氮中心自由基捕获剂,该课题组成功实现了烷基羧酸的直接光氧化还原催化脱羧胺化。该方法在无需对羧酸预活化及无需过渡金属参与的条件下,实现了温和、高效的胺化过程,并展现出优良的官能团兼容性。该策略适用于多种结构类型的羧酸底物,包括环状、链状、三级羧酸以及复杂天然产物和药物衍生物,能够高效转化为具有潜在药用价值的亚胺产物(图2)。
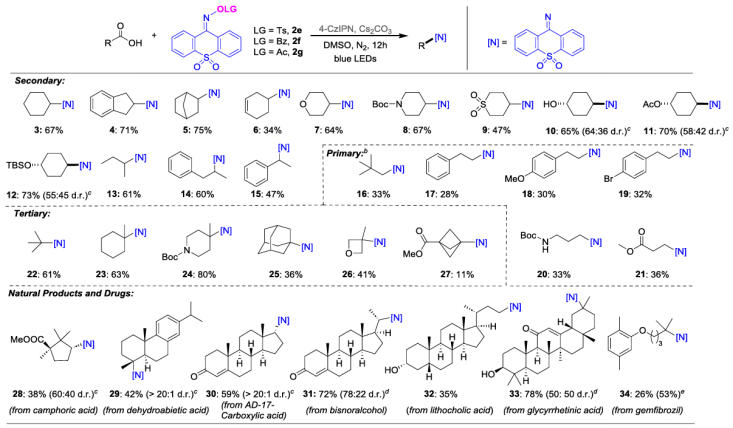
图2. 底物拓展(图源:Chin. J. Chem.)
基于实验机理研究和DFT理论计算,作者提出了两种可能的途径。在途径I中,原位生成的羧酸根阴离子A被激发的光催化剂单电子氧化,释放出一分子CO2后生成自由基B。然后B与2f发生加成,得到中间体C,随后发生β-断裂,得到产物3并生成苯甲酰氧自由基。最后,苯甲酰氧自由基被还原的光催化剂还原为苯甲酸根阴离子。途径II通过自由基-自由基偶联机制。胺化试剂2f被还原的光催化剂还原形成中间体D,然后通过β-消除苯甲酸根阴离子生成亚胺自由基E。最终通过环己基自由基B和亚胺自由基E之间的交叉偶联生成产物3a(图3)。
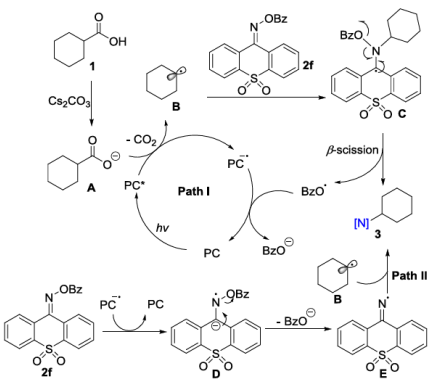
图3. 可能的机理(图源:Chin. J. Chem.)
为了突出方法的实用性,吴晶晶课题组将反应扩大为克级规模,并以43%的产率得到了产物8。亚胺产物可以在温和条件下水解得到游离胺。为了证明这一优势,对甾体化合物30进行了水解实验,以良好的产率和优异的非对映选择性得到了C17-α-胺产物40。值得注意的是,以前通过化学合成获得的甾体C17胺主要呈现β-构型或作为α/β混合物存在。获得单一构型的C17-α-胺完全依赖于酶催化。该方法为C17-α-胺提供了有效的合成途径。除了游离胺产物外,水解产物酮41也可以以79%的产率回收,它可以被重新作为原料合成胺化试剂2f。该方法也可以应用于药物化合物苯丙胺盐酸盐43的合成。之前文献报道的策略需要4步,但该方法在3步内可以实现(图4)。
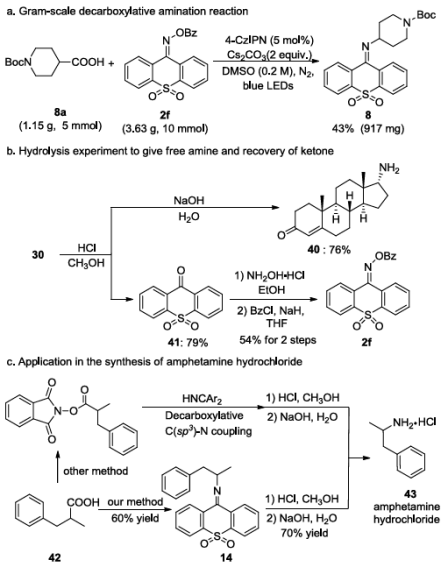
图4. 脱羧胺化的放大实验、水解实验与合成应用(图源:Chin. J. Chem.)
上述研究结果以Concise Report形式发表于Chin. J. Chem.杂志上(Chin. J. Chem. 2025, 43, 3575—3581)。该项工作得到了国家自然科学基金青年科学基金项目、中央高校基本科研业务费、“青年千人计划”及上海交通大学启动经费的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




