【JACS】普林斯顿大学诺奖得主MacMillan团队:镍金属光氧化还原催化促进脱氧C(sp³)−N(sp³)交叉偶联反应

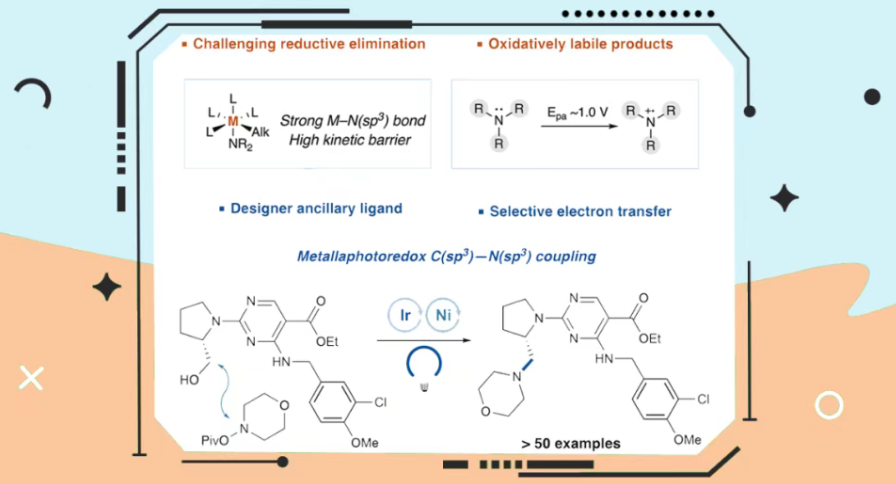
近日,美国普林斯顿大学David W. C. MacMillan课题组报道一种醇与N-羟基胺酯经脱氧C−N交叉偶联生成叔胺的反应。优化反应条件下,叔胺产物的氧化反应在动力学上受到抑制。同时,空间位阻大的辅助配体可促进还原消除。此外,该方法具有广泛的底物范围,可兼容多种官能团、杂环化合物及药物分子衍生物。相关研究成果发表在J. Am. Chem. Soc.上。
富含sp³-杂化单元的分子结构因其优越的药理性质和较高的临床成功率,代表了当代有机化学中重要的合成目标。其中,带有C(sp³)-N(sp³)键的三级胺尤其引人关注,因为在近期FDA批准的药物中,超过80%含有至少一个饱和氮杂环,其中近半数是全饱和的(Figure 1A)。值得注意的例子包括哌啶、吡咯烷、哌嗪和吗啉,它们均位列现代治疗药物中最常见的十种杂环结构之中。前期,亲核取代与羰基还原胺化是合成脂肪胺最为广泛的方法之一。然而,这些方法可能受限于空间位阻、苛刻反应条件以及消除反应和过度烷基化等副反应。因此,研究者们投入大量精力开发更温和高效的方法,以期通过烷基亲电试剂构建叔脂肪胺。例如,通过将开壳层中间体与过渡金属催化相结合,王毅课题组实现了净还原交叉亲电偶联反应,Gregory C. Fu课题组实现了光激发铜介导卤素原子转移(XAT)活化策略。尽管这些精妙方法实现了卤代烷向脂肪胺的转化,但使用醇类化合物进行类似的反应,却存在反应条件苛刻、底物范围狭窄等问题。2024年,MacMillan课题组开发了一种净氧化性铜介导的醇类脱氧C-N偶联反应,实现了醇与N(sp²)偶联底物的结合,但未能实现对N(sp³)杂化类似物的偶联(Figure 1B)。事实上,通过金属光氧化还原催化合成叔胺主要存在两个挑战。首先,构建C(sp³)-N(sp³)键所需的还原消除步骤本质上不利,这既源于金属-氮键的强度,又源于C(sp³)-N(sp³)还原消除过程中显著重组能引起的高动力学能障。其次,叔胺具有相对较低的氧化电位,易被光催化剂氧化,从而导致产物抑制现象。为了解决上述的问题,近日,MacMillan课题组报道一种镍金属光氧化还原催化醇类化合物与N-羟基胺酯衍生物的脱氧C(sp³)−N(sp³)交叉偶联反应,合成了一系列叔胺衍生物(Figure 1C)。
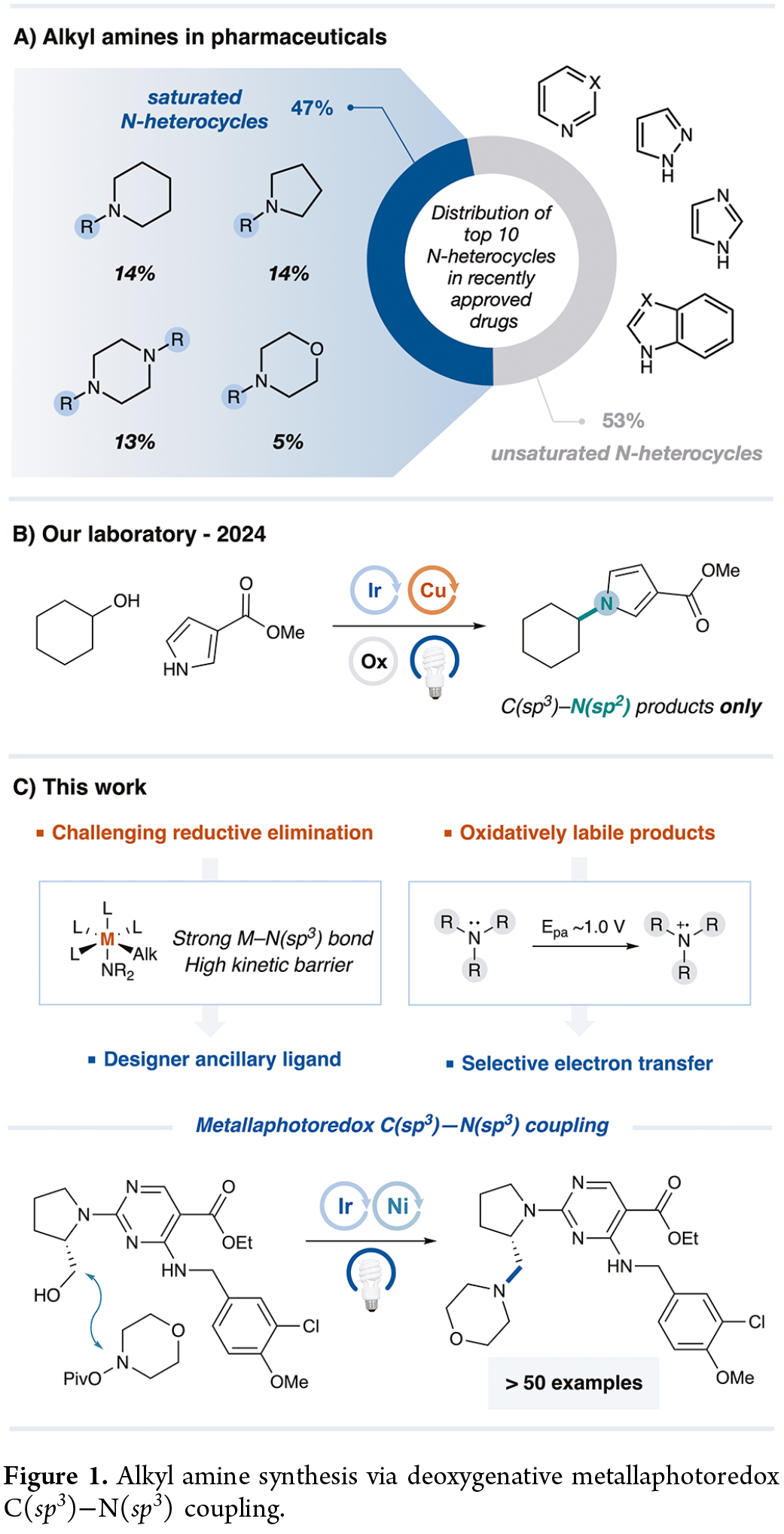
(Figure 1,图片来源:J. Am. Chem. Soc.)
首先,作者以N-Cbz-哌啶-4-醇与N-羟基吗啉酯作为模型底物,对反应条件进行了大量的筛选(Figure 2)。筛选结果表明,当以NHC-1作为醇活化剂,吡啶作为碱,NiCl₂作为金属催化剂,6,6′-双(4,4-二甲基-4,5-二氢噁唑-2-基)-2,2′-联吡啶作为配体,[Ir(ppy)₂(dtbbpy)]PF₆作为光催化剂,邻苯二甲酰亚胺作为添加剂(防止镍氧化加成配合物的分解),MTBE/MeOH作为混合溶剂,可以78%的收率得到偶联产物。值得注意的是,对于一些无电性差异的N(sp³)底物,上述条件反应效率较差。通过进一步的优化后发现,采用NHC-2作为醇活化剂,MTBE/正丙醇作为混合溶剂,琥珀酰亚胺作为添加剂,可以68%的收率得到偶联产物。
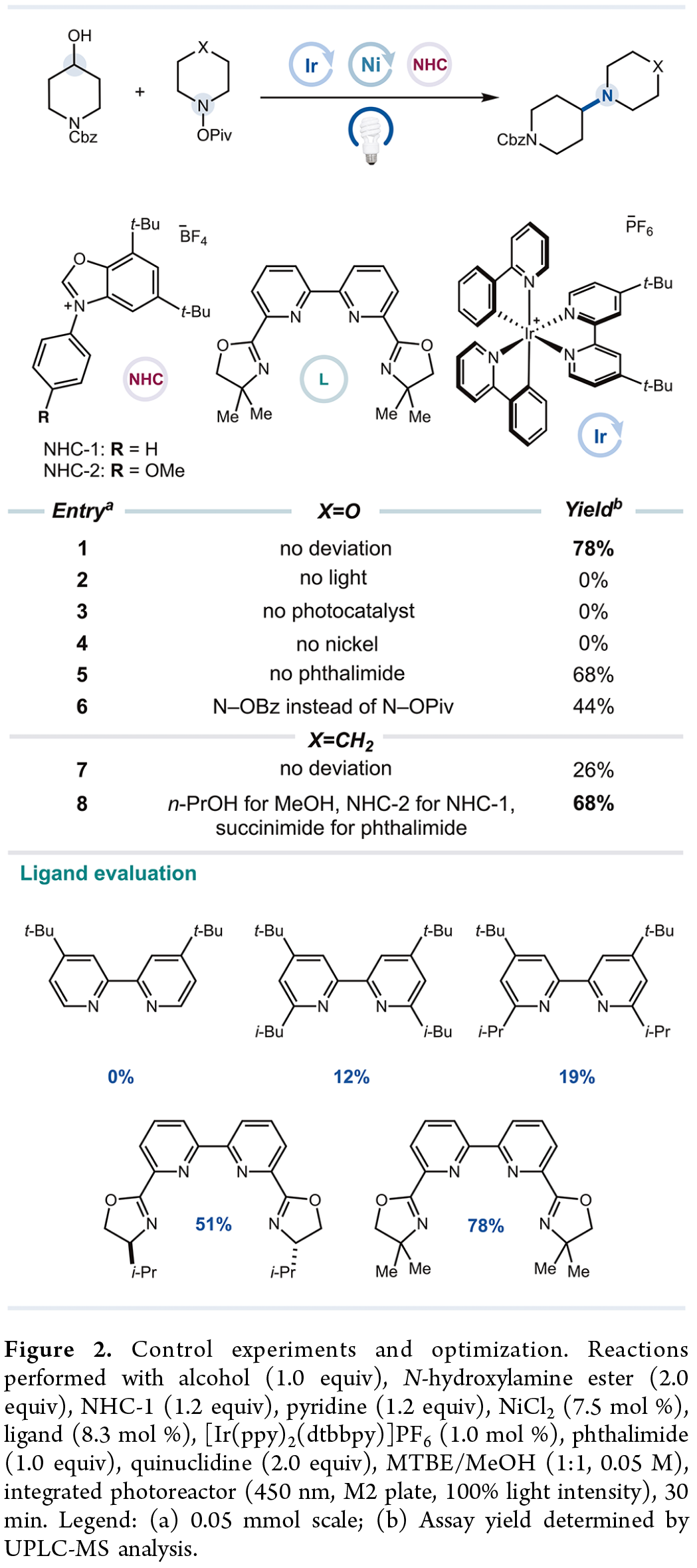
(Figure 2,图片来源:J. Am. Chem. Soc.)
在获得上述最佳反应条件后,作者对醇的底物范围进行了扩展(Figure 3)。首先,一系列不同取代的伯醇与仲醇,均可顺利进行反应,获得相应的产物1-8,收率为51-74%。其次,含有卤代烷基官能团的醇类化合物,也与体系兼容,获得相应的产物9(收率为51%)和10(收率为52%)。同时,含有游离羰基的醇类化合物,也能够顺利进行反应,获得相应的产物11-14,收率为51-73%。此外,多种含芳基卤化物的醇类化合物,均可顺利进行反应,获得相应的产物15-20,收率为55-75%。值得注意的是,含有杂环取代的醇类化合物,也与体系兼容,获得相应的产物21-25,收率为44-67%。
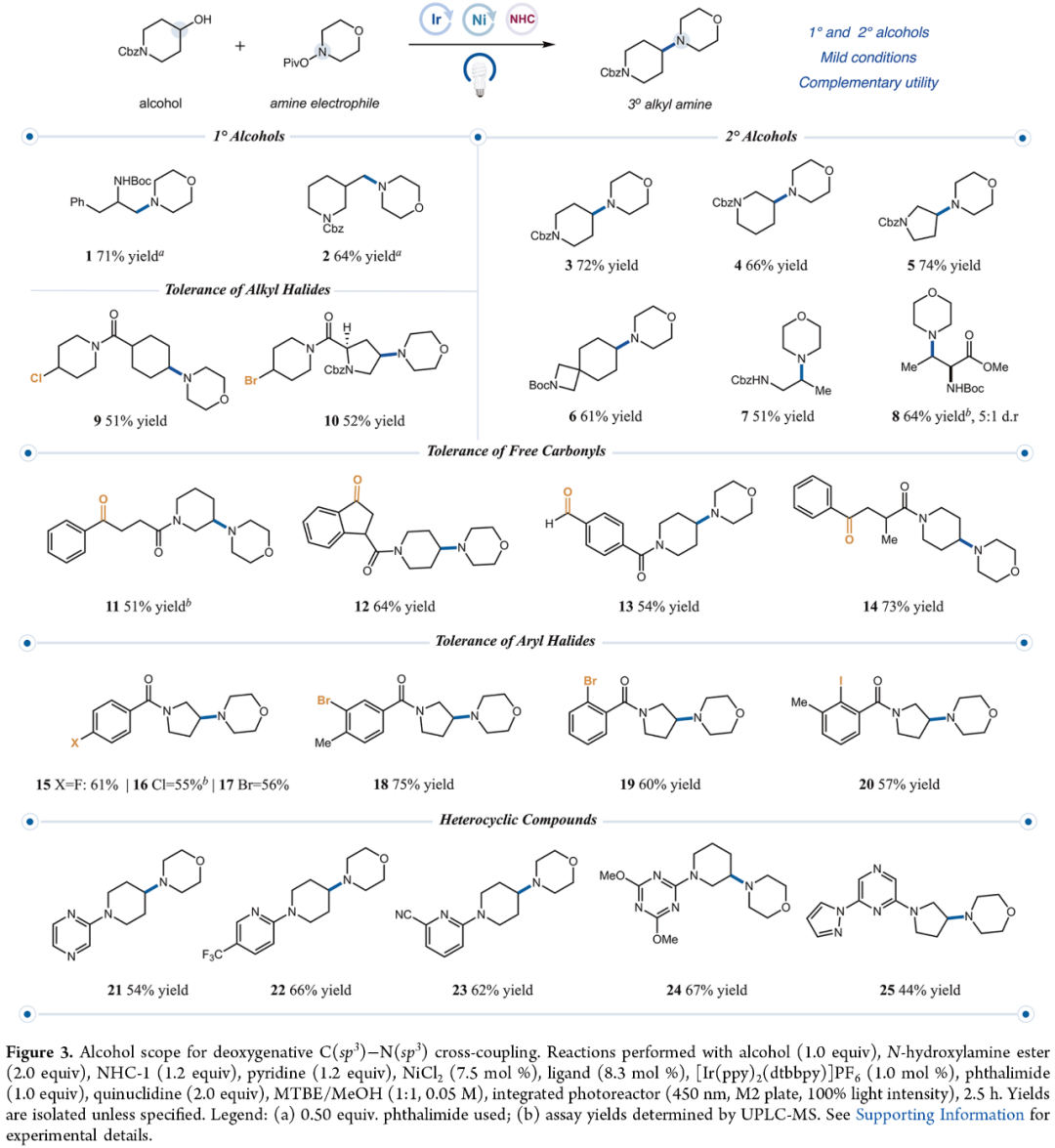
(Figure 3,图片来源:J. Am. Chem. Soc.)
紧接着,作者对胺的底物范围进行了扩展(Figure 4)。研究结果表明,多种N-羟胺酯均能高效发生交叉偶联反应。其中,开链仲胺类N-羟胺(26-28、34和35,收率51−69%)、衍生自氮杂环丁烷(36,收率63%)、吡咯烷(29和40,收率均为51%)、哌嗪(30、31和39,收率54−60%)、哌啶(32、33和38,收率60−72%)及螺环胺(37,收率72%)的胺类底物,也表现出良好活性。同时,喹啉衍生的胺类化合物,可以46%的收率得到产物41。其次,该策略还可用于相关药物分子的后期衍生化,如非布司他、阿伐那非、氟西汀衍生物等,获得相应的产物42-46,收率为50-89%。此外,通过含有羰基的洛索洛芬衍生物的一步衍生化反应,实现了胺化类似物小型化合物库的高效合成(47-50,收率59−81%)。
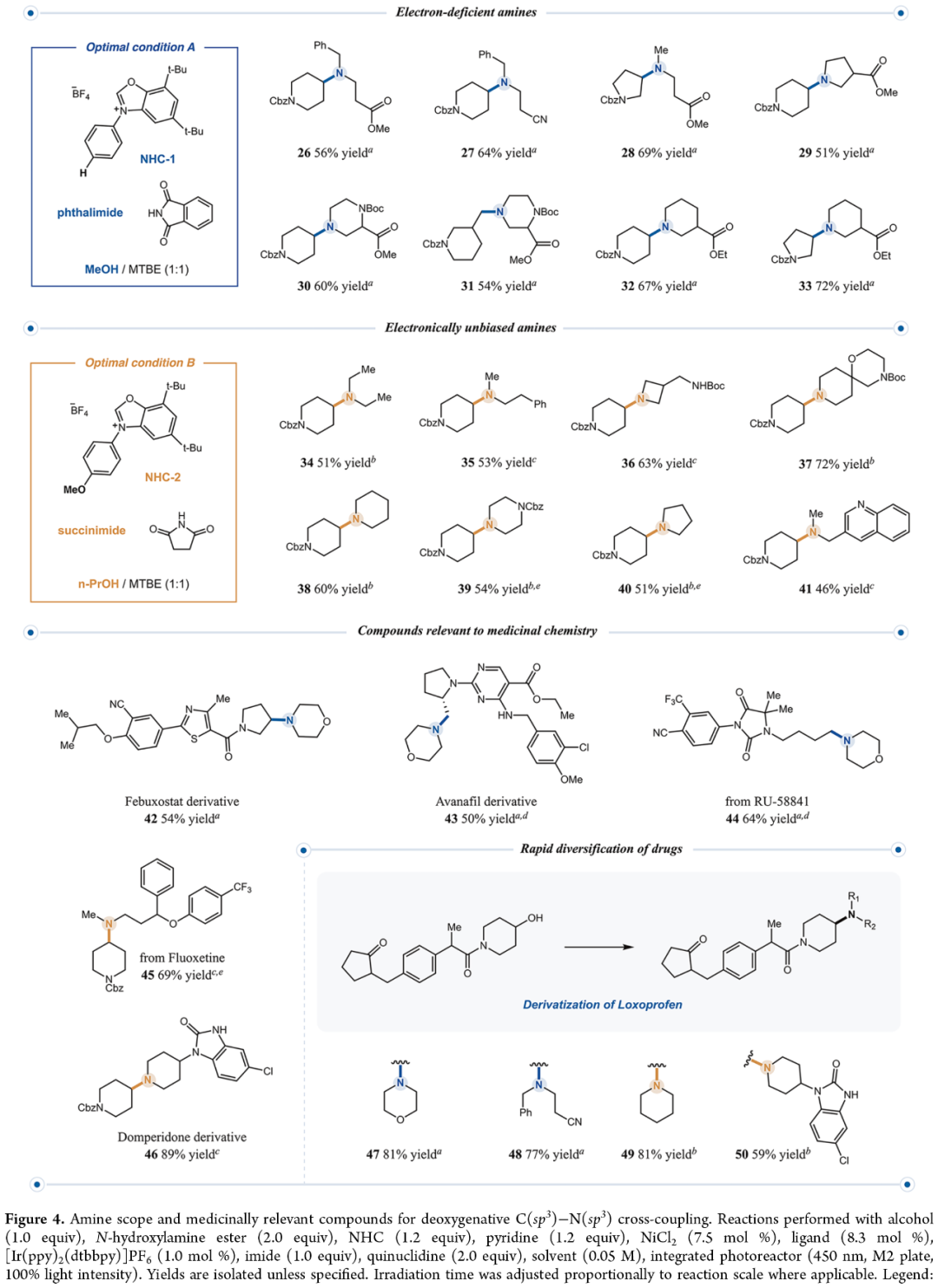
(Figure 4,图片来源:J. Am. Chem. Soc.)
最后,作者对反应的机理进行了研究(Figure 5)。首先,作者提出了一种合理的反应机理(Figure 5A)。具体过程如下:醇先与NHC盐反应形成相应加合物52。在蓝光照射下,激发态铱光催化剂55被加合物52选择性还原淬灭,生成还原态光催化剂56及NHC-醇自由基阳离子。该中间体经去质子化生成自由基53,后者通过β-键断裂生成碳中心自由基60。与此同时,Ni(0)物种57对N-羟基胺酯58中N-O键进行氧化加成,生成Ni(II)配合物59。配合物59捕获自由基60生成Ni(III)配合物61,其经还原消除得到C-N交叉偶联产物63和还原态Ni(I)配合物62。两个催化循环通过还原态铱光催化剂56介导的单电子还原(62→Ni(0))完成闭环。其次,为了进一步的验证上述的机理,作者还进行了相关的实验研究(Figures 5B-5E)。通过Ni-(COD)₂合成Ni(II)氧化加成配合物,在化学计量反应条件下,成功获得预期的C−N偶联产物,证实了Ni(II)中间体参与催化循环的机理(Figure 5B)。CV实验结果表明,激发态光催化剂对NHC-醇加合物与C−N偶联产物的氧化过程在热力学上均可行。同时,反应选择性源于动力学控制而非热力学控制,并且延长辐照时间将导致最终产物发生降解(Figure 5D)。在Stern-Volmer研究中发现,在Conditions A条件下,电性无差异的胺进行电子转移速率与NHC-醇加合物相当,这与该底物在Conditions A中观测到的低效率相吻合。反之,缺电子胺的电子转移速率较NHC-醇加合物更慢,这使得偶联反应得以占据主导地位,从而抑制产物氧化降解。将共溶剂从甲醇切换为正丙醇(Condition B)后,电性无差异胺的氧化受到抑制(相对于NHC-醇加合物)。该现象可通过胺自由基阳离子更高的溶剂化敏感性合理解释,因其共轭程度较NHC-醇自由基阳离子更低。因此,低介电常数溶剂混合物有助于NHC-醇加合物的选择性氧化(Figure 5E)。此外,带有富电子对甲氧苯基的NHC-2-醇加合物,其氧化反应活性显著高于NHC-1对应物,该效应进一步强化了体系的选择性。
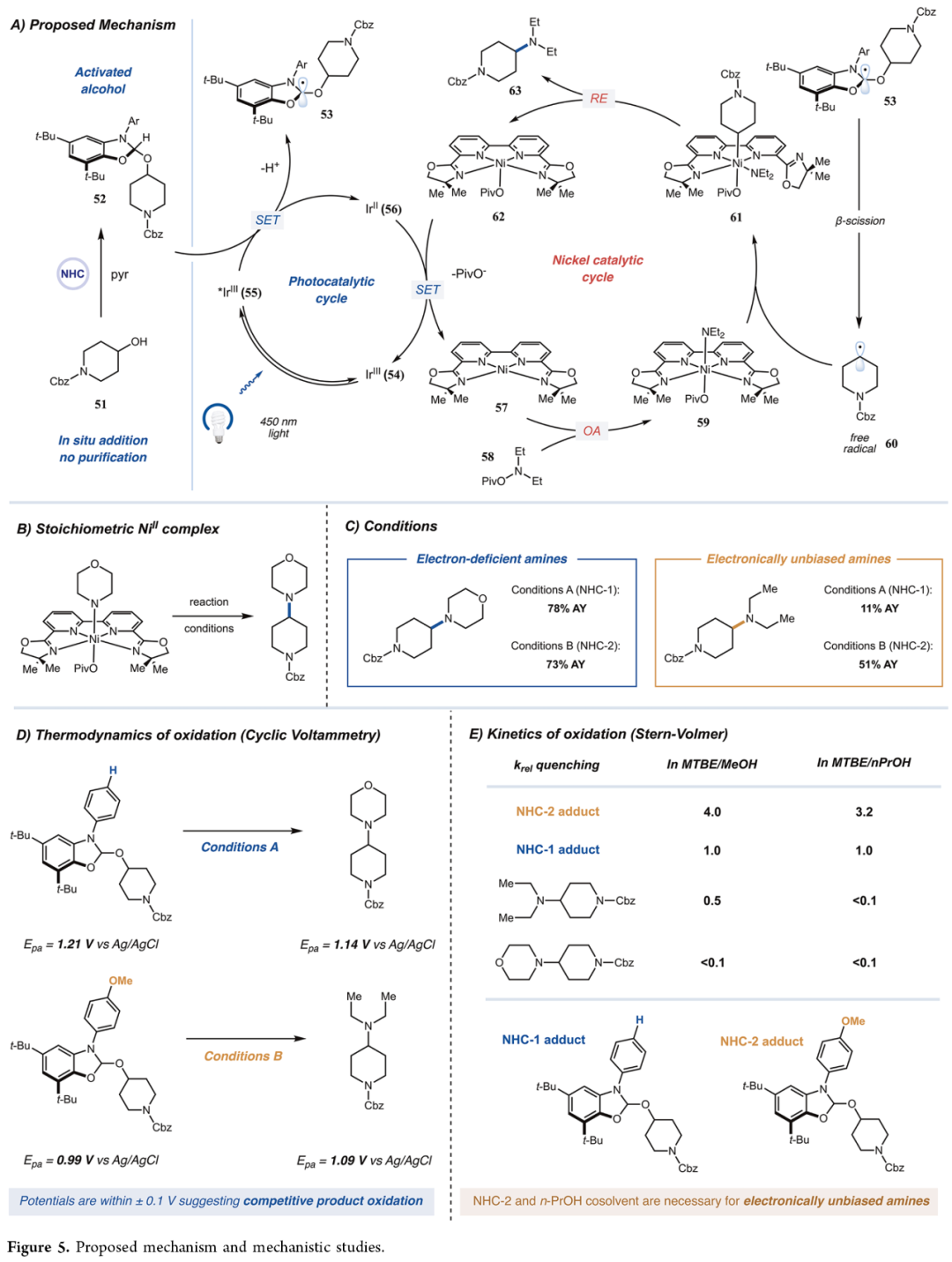
(Figure 5,图片来源:J. Am. Chem. Soc.)
美国普林斯顿大学David W. C. MacMillan课题组开发了一种镍金属光氧化还原催化平台,实现了脂肪醇与N-羟基胺酯的交叉偶联反应。通过NHC试剂对醇的原位活化,可经由动力学有利的NHC加合物氧化途径生成烷基自由基。在完成N-O键的氧化插入及后续烷基自由基捕获后,特别设计的空间位阻型双(噁唑鎓)联吡啶(bis(oxazolium)bipyridine)镍催化剂有效促进了具有挑战性的C(sp³)-N(sp³)还原消除步骤。该策略在温和的光氧化还原条件下,以优异的官能团耐受性实现了对氧化敏感叔胺化合物的高效合成。
论文信息:
Deoxygenative C(sp³)−N(sp³) Cross-Coupling Enabled by Nickel Metallaphotoredox Catalysis
Ruizhe Chen, Taehyun Kim, Noah B. Bissonnette, Robert T. Martin, Joseph R. Martinelli, Albert Cabré, David W. C. MacMillan
J. Am. Chem. Soc. 2025
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




