【Angew. Chem.】华中师大张国柱教授/郭瑞研究员:通过光氧化还原催化与三重氢原子转移实现酰胺与非活化烯烃的氢烷基化
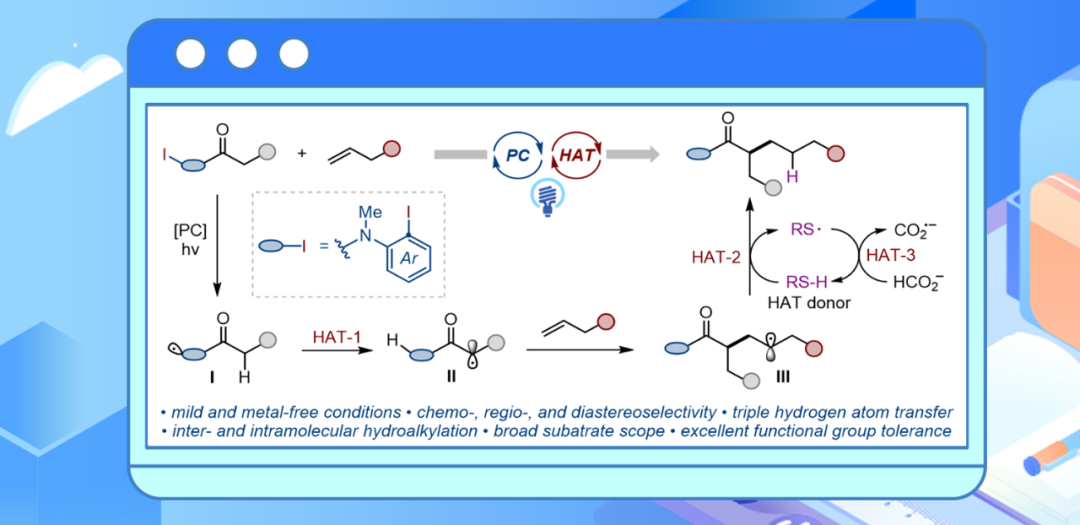
羰基化合物因其优异的化学稳定性和生物活性在天然产物中扮演着重要角色。其中,羰基化合物的α-位烷基化反应作为有机合成的核心反应,能够高效构建药物、天然产物及农用化学品中常见的官能团骨架(图1a)。传统的α-烷基化方法通常依赖于烯醇负离子与烷基亲电试剂的反应。尽管该策略应用广泛,但仍存在明显局限性,相比之下,利用羰基化合物与烯烃的氢烷基化反应,可以更直接且更具原子经济性地获得α-烷基化羰基化合物。然而,现有离子型策略大多局限于活化烯烃或分子内反应,且往往依赖贵金属催化剂并需要苛刻的反应条件。另一方面,基于自由基的非活化烯烃氢烷基化为构建α-烷基化羰基化合物提供了另一种高效而具有吸引力的策略。但目前的方法仍主要局限于活泼的1,3-二羰基化合物,且往往需要化学计量的氧化剂、过量的羰基底物、以危险的乙酸作溶剂以及较高的反应温度(图1b)。近年来,随着光氧化还原催化与氢原子转移(HAT)催化的发展,光诱导氢烷基化逐渐成为构建α-烷基化产物的一种有前景的策略(图1b-ii)。尽管取得了这些进展,目前体系仍主要局限于含有多个吸电子基的底物,如1,3-二羰基化合物、氰基乙酸酯和吡啶基乙酸酯。单羰基化合物生成的碳自由基的电亲性明显低于1,3-二羰基化合物及其类似物,其向非活化烯烃的自由基加成更具挑战性(图1b-iii)。因此,开发一种温和、普适且选择性良好的能够实现含有复杂官能团或手性中心的单羰基化合物与非活化烯烃的反应,仍有待深入研究(图1b-iv)。近年来,华中师范大学化学学院张国柱教授和郭瑞研究员团队利用芳基自由基介导的分子内和分子间氢原子转移(HAT)过程,实现了一系列惰性C(sp³)─H键的活化与官能化(Angew. Chem. Int. Ed. 2022, 61, e202208232;ACS Catal. 2024, 14, 1725–1732;Angew. Chem. Int. Ed. 2024, 63, e202409310;J. Am. Chem. Soc. 2025, 147, 22072–22083, ACS Catal. 2025, 15, 15425–15434)。
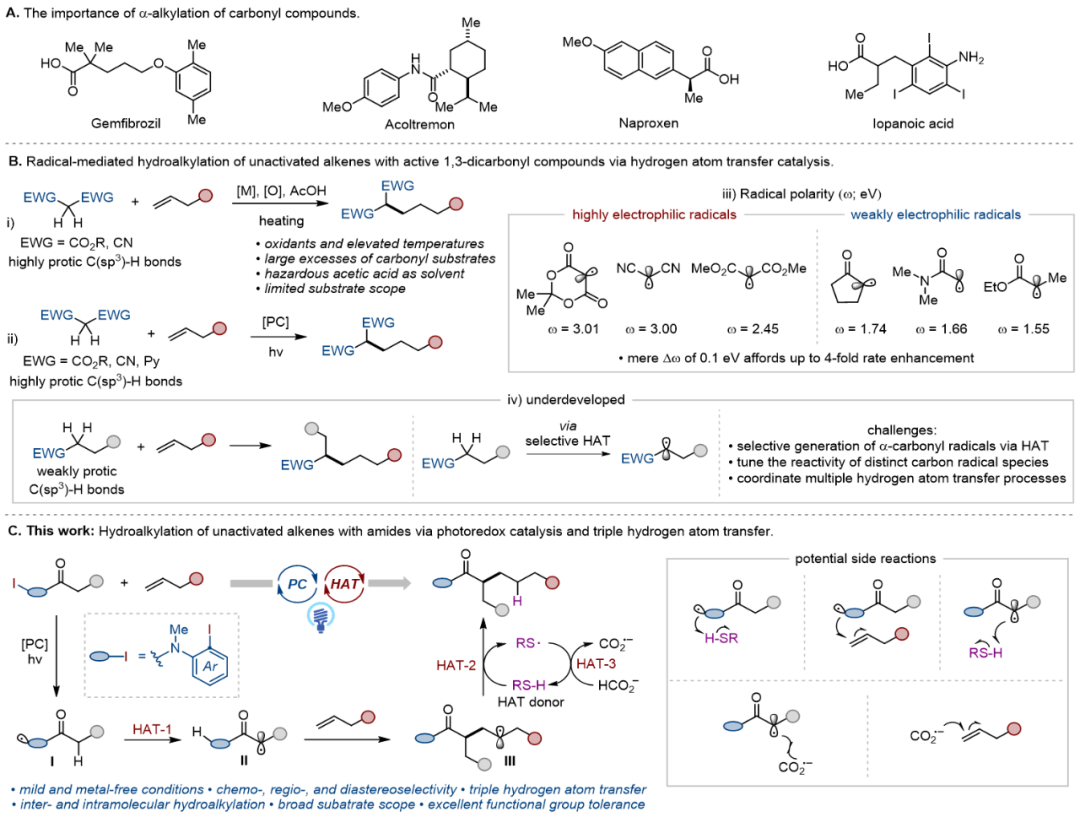
图1 研究背景(图片来源:Angew. Chem. Int. Ed.)
基于此,该团队报道了一种光诱导芳基自由基介导的氢烷基化反应(Angew. Chem. Int. Ed. 2025, e202516794. )。通过选择性地生成α-羰基自由基中间体,实现了自由基介导的复杂官能团取代的单羰基化合物与非活化烯烃的氢烷基化反应(图1c)。
作者首先以酰胺A1和1-己烯(B1)作为模型底物对条件进行了筛选,反应在DMSO中进行,以金刚烷硫醇作为HAT供体,甲酸钠作为还原剂,在蓝光LED照射下考察其反应性。当采用铜或铱光催化剂时,目标产物1分别以45%和42%的收率获得(表1),进一步筛选发现,硫代苯酚类的表现均逊于Ad-SH,突显了Ad-SH在本转化中的优势,溶剂筛选结果表明,DMSO为本反应的最佳溶剂。综合考察,表1中条目7的条件被确定为最佳反应条件。
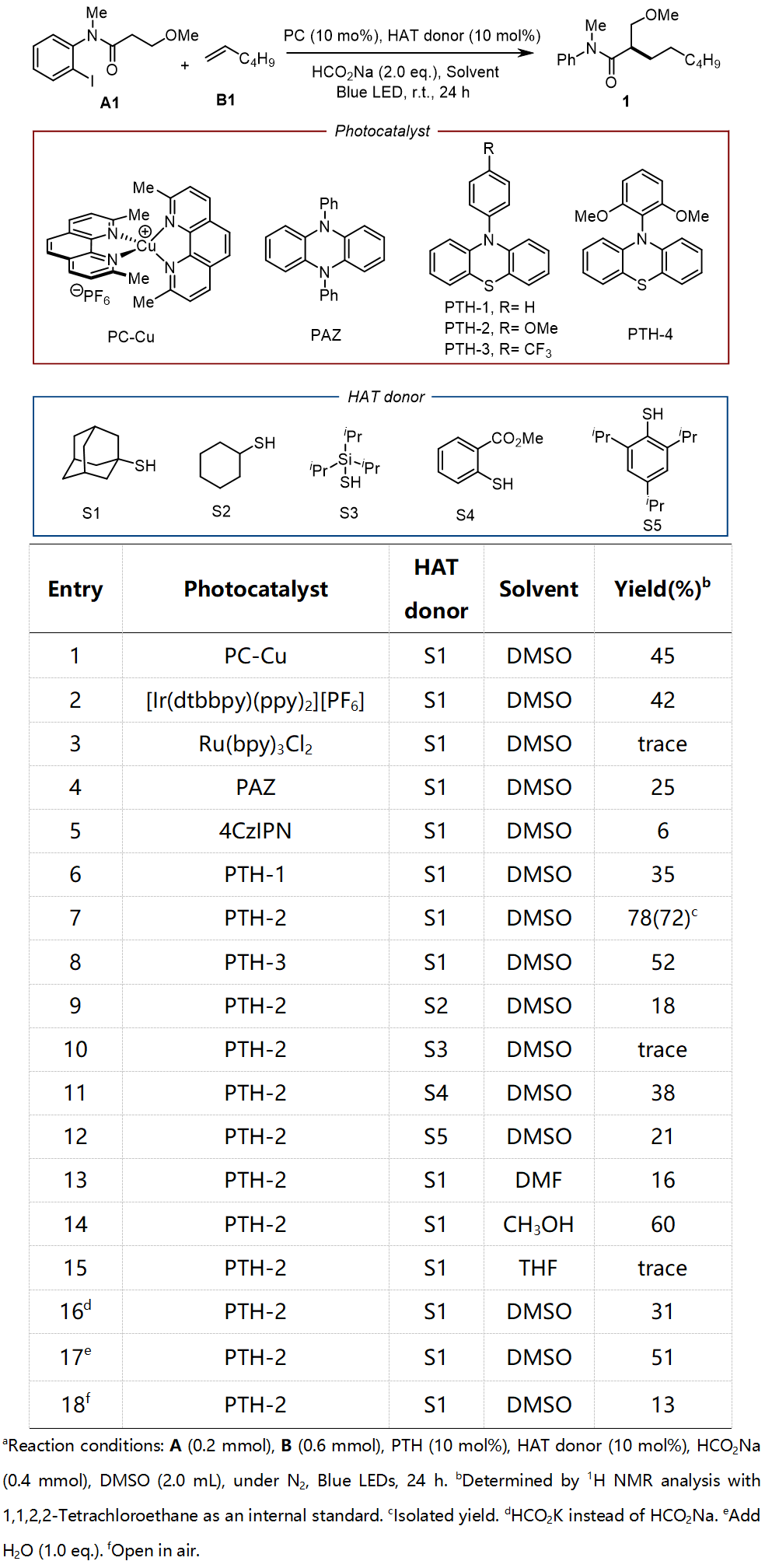
表1 条件筛选(图片来源:Angew. Chem. Int. Ed.)
在确定最优的反应条件后,作者对反应的普适性进行了考察(表2)。实验结果表明不同链长的酰胺以及链上带不同取代基的酰胺都能以良好的收率得到目标产物。同时,多种带有不同取代基的非活化烯烃也能以中等到良好的收率合成相应的产物。重要的是,一些气态烯烃如乙烯、丙烯、正丁烯和异丁烯也能顺利参与反应,凸显了该方法对低沸点、挥发性底物的良好适用性。
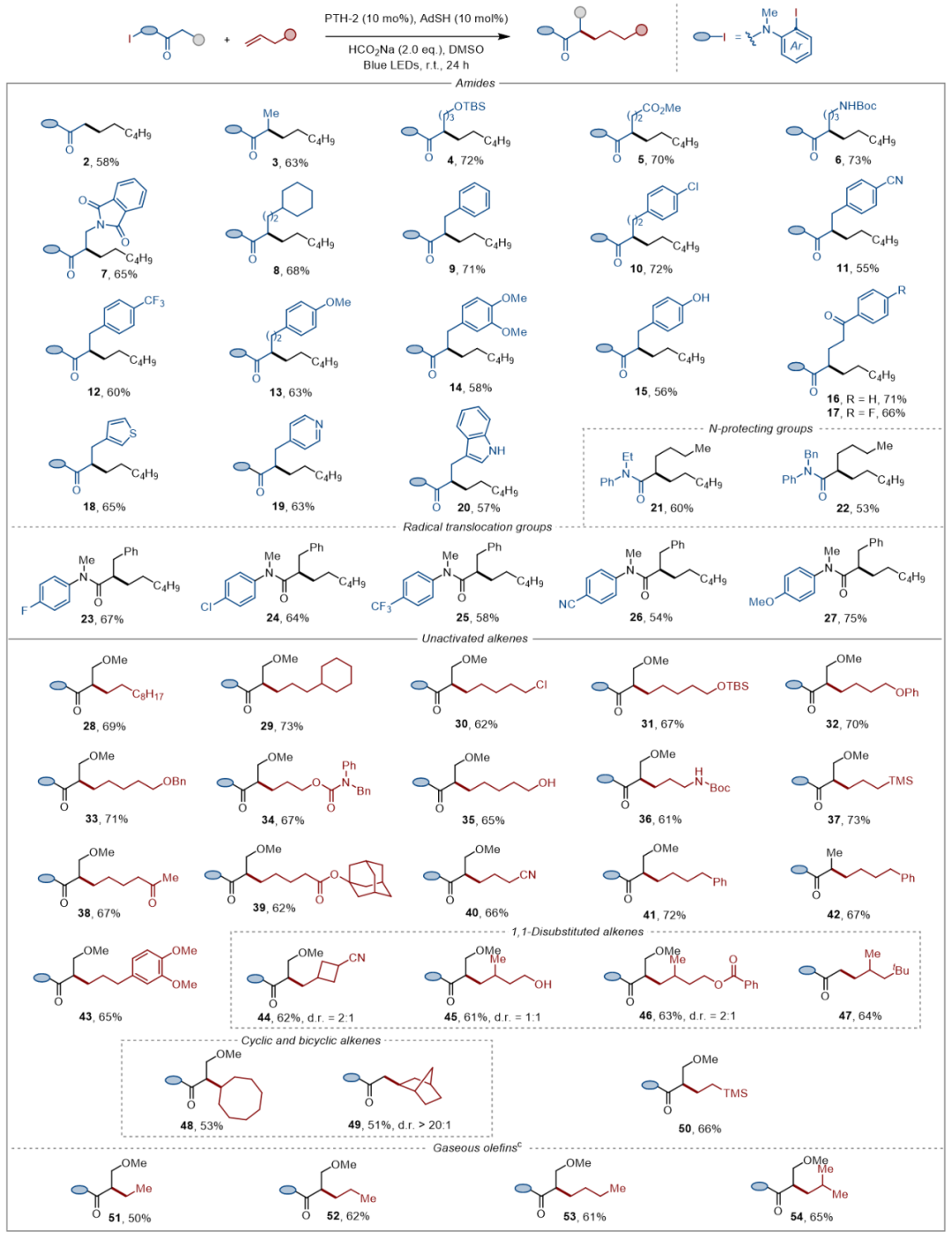
表2 底物范围(图片来源:Angew. Chem. Int. Ed.)
如图2a所示,作者进一步评估了一系列结构复杂的药物分子,以验证该转化在药物研发中的潜在应用价值。结果表明,包含替米沙坦、瑞格列奈等结构片段的酰胺底物在标准条件下均能顺利转化。此外,多种含有多个碳碳双键的天然产物如(−)-β-蒎烯、(−)-紫苏醛也能直接参与反应。综合来看,这凸显了该烷基化方法在复杂分子结构上的广泛适用性与优异的官能团兼容性。
随后作者进行了一系衍生实验,构建含有季碳中心的产物,此外还对酰胺进行了还原以及醇解。同时还对底物41进行了消除得到α,β-不饱和酰胺。该策略还可通过分子内 HAT 和自由基环化快速高效地构建环状产物,同时该方法在药物化学中也展现了应用潜力如构建吉非罗齐和Acoltremon 类似物。
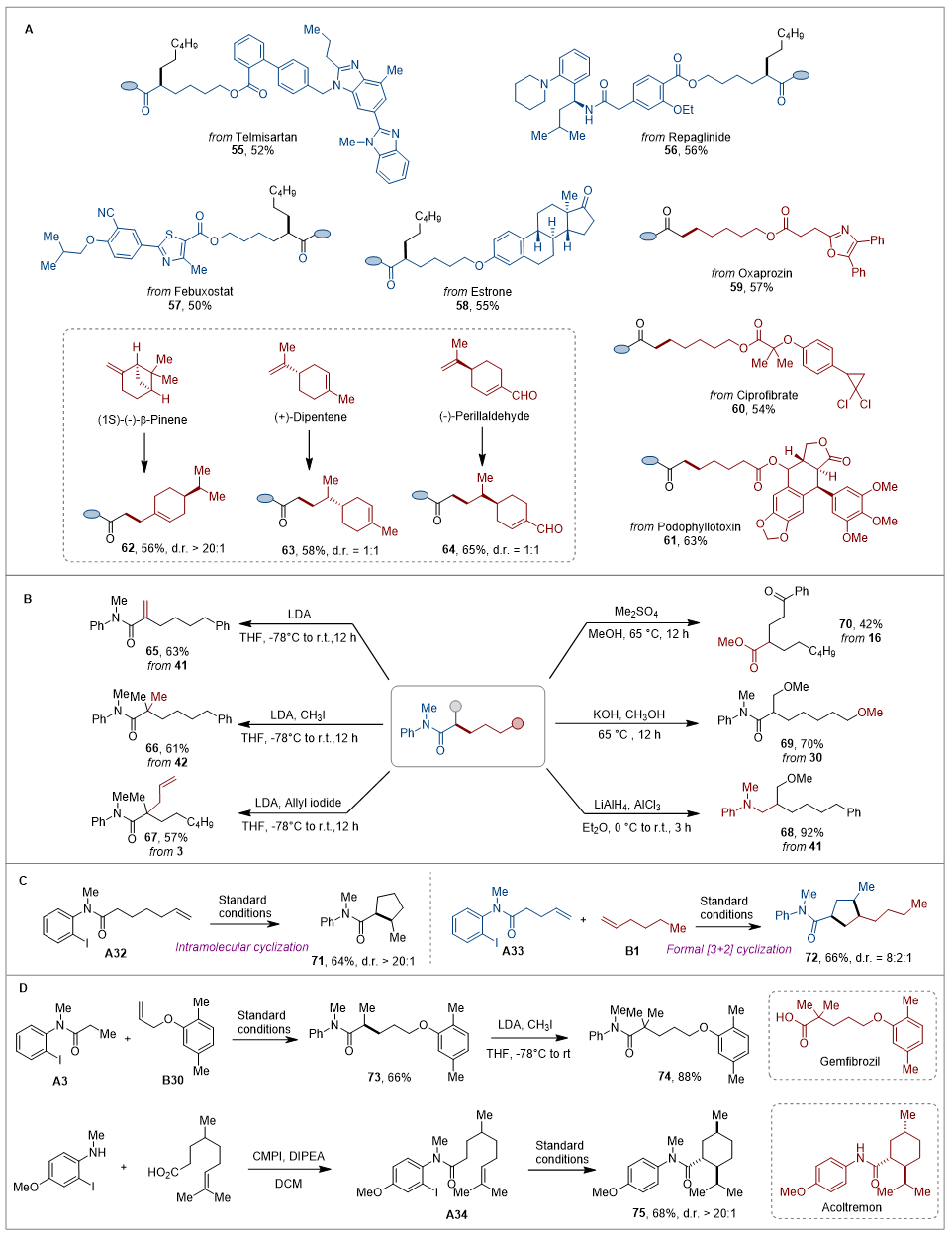
图2 拓展应用(图片来源:Angew. Chem. Int. Ed.)
为更深入地理解该反应机理,作者进行了机理实验(图3)。首先,加入自由基捕获剂TEMPO后反应被完全抑制,并通过HRMS检测到相应的 TEMPO 加合物 76 和77,这表明芳基自由基、α-羰基自由基以及硫自由基是该反应的关键中间体(图 3a)。其次,氘标记实验证明了硫醇在分子间 HAT 过程中的供氢作用(图 3b)。同位素效应(KIE)实验证明,分子内 1,5-HAT 并不是该反应的速率决定步骤(图 3c)。此外,紫外–可见吸收光谱结果表明,在反应条件下,PTH 光催化剂是在 325 nm 激发波长下的光吸收物种(图 3d)。Stern–Volmer 分析进一步证明,芳基碘代物是该反应的淬灭剂(图 3e)。光开关实验(图 3f)的结果排除了自由基链式反应的可能性。最后,作者在标准反应条件下考察了 α-卤代酰胺 A35 和A36 的反应性(图3g)。当使用这两类 α-卤代酰胺均产生了大量脱卤副产物、和酰氧取代副产物、(图 3g,i)。在不进行蓝光 LED 照射的对照实验中发现,酰氧取代副产物 80 来自HCO₂Na 与 α-卤代酰胺之间的亲核取代反应(图 3g,ii)。这些结果凸显了我们所建立的催化体系在促进高效 α-烷基化的同时,能够有效抑制副反应的独特优势。
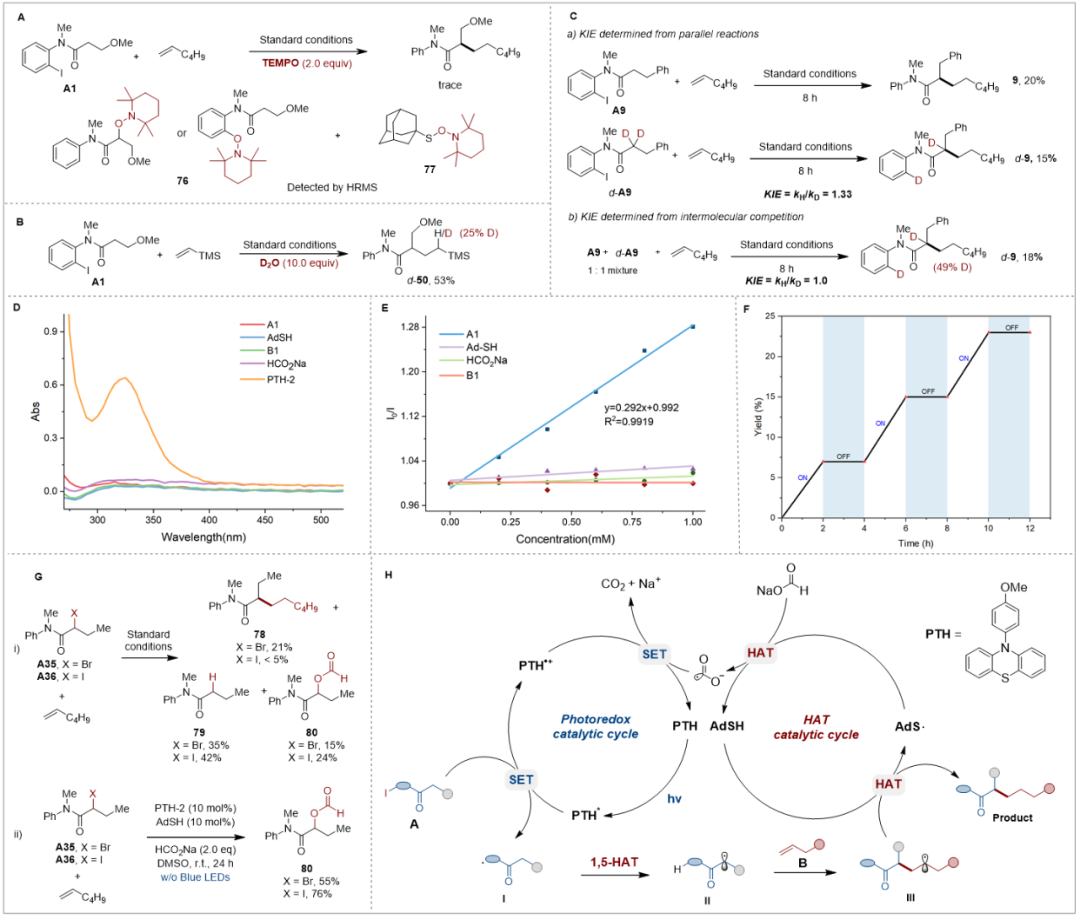
图3 机理研究(图片来源:Angew. Chem. Int. Ed.)
作者提出了可能的反应机理(图3h),在蓝光 LED 照射下,底物 A 与激发态光催化剂PTH* 发生SET过程,生成芳基自由基 I 和自由基阳离子。芳基自由基I 随后经历分子内1,5-HAT,生成关键的 α-羰基自由基 II。其后,该自由基II 与非活化烯烃B 加成得到烷基自由基III。该自由基III 通过与Ad-SH 的第二次氢原子转生成目标产物,并产生硫自由基 AdS•。硫自由基 AdS• 随后从甲酸钠(HCO₂Na)中攫取氢原子,经生成CO₂•⁻,该自由基阴离子通过单电子转移将PTH•⁺ 还原为基态PTH,从而完成整个催化循环。
综上所述,华中师范大学张国柱/郭瑞团队报道了一种光诱导、普适性强且实用的未活化烯烃与酰胺的氢烷基化反应。该反应在温和无金属条件下实现了分子间与分子内的氢烷基化,展现出优异的化学、区域和非对映选择性,同时具备广泛的底物适用性和出色的官能团耐受性。包括乙烯在内的多种短链气态烯烃也能成功参与反应。通过结构复杂生物活性分子的多样化后期修饰与合成,进一步凸显了该方法的通用性。机理研究表明,该反应通过包含分子内与分子间步骤的三重氢原子转移(HAT)过程进行,其成功实施得益于弱亲电性α-羰基自由基的可控生成,以及自由基极性匹配/错配效应的策略性应用,从而精准调控不同的碳自由基物种与未活化烯烃或HAT供体间的反应活性。这一结合了光氧化还原催化与多重氢原子转移的策略,在解决惰性C(sp³)–H键活化及非活化烯烃氢烷基化等长期挑战性问题方面具有重要潜力。
该研究得到国家自然科学基金的大力支持,相关研究成果发表在Angew. Chem. Int. Ed.上(DOI:10.1002/anie.202516794)。文章在审稿过程中得到审稿人的一致高度评价(Top 5%), 并被编辑选为VIP论文。华中师范大学硕士研究生易贝贝为该论文的一作者,张国柱教授和郭瑞研究员为本文通讯作者。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




