【CJC】中量大庄诗怡/金伟伟/新疆大学刘晨江:电化学杂芳基烷基硫醚的C(sp³)–S/C(sp²)–S键选择性断裂
含硫化合物是生物体的重要组成成分,通常以氨基酸、肽、蛋白质及酶等形式存在。因其广泛存在于各类天然产物、药物及农用化学品中,同时还是有机合成化学领域关键的前体与中间体,这类化合物已引起研究者的高度关注。其中C–S键断裂能为实现含硫结构的转化与重构提供直接途径,因此对合成化学具有重要意义。
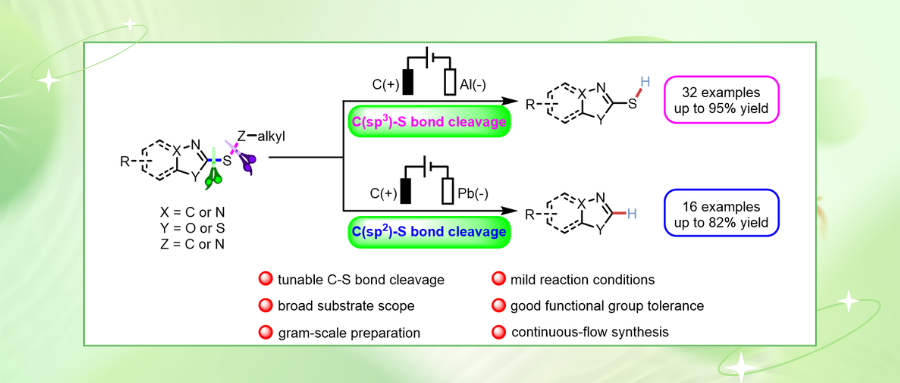
由于C(sp³)–S键的解离能比C(sp²)–S键更高,其断裂在动力学上更为困难,因此高化学选择性活化C(sp³)–S键的研究鲜有报道,目前仍是极具价值的挑战性课题之一。此外开发环境友好、经济高效的无过渡金属催化的C–S键活化新方法仍有待探索。近日,中国计量大学庄诗怡、金伟伟课题组和新疆大学刘晨江课题组合作研究发现了一种电化学介导的杂芳基烷基硫醚选择性C(sp³)–S/C(sp²)–S键断裂新方法。该转化具有无过渡金属、无外加氧化剂和催化剂的显著特征,通过高化学选择性的脱烷基化或脱硫反应路径实现了碳硫键的断裂,兼具操作简便性与优良的官能团耐受性。此外,放大实验与单通道连续流电化学合成则进一步验证了该策略具有潜在的应用价值。相关成果发表于Chin. J. Chem. 2025, 43, 2722—2728。
传统的碳硫键断裂策略主要依赖过渡金属催化剂通过氧化加成过程实现(图 1a)。然而该方法存在诸多局限性:(1)通常需在较高的反应温度及相对苛刻的条件;(2)硫原子的强配位作用易使过渡金属催化剂失活;(3)过渡金属的残留问题阻碍了其在制药与生物领域的应用;(4)相比C(sp²)–S键,由于C(sp³)–S键的解离能更高,其断裂在动力学上更为困难,因此高化学选择性活化C(sp³)–S键的研究鲜有报道,目前仍是极具价值的挑战性课题之一。
近年来,光催化与电催化有机合成已成为构建新型化学键及有机化合物的强大工具。其中,电化学合成使用电子作为“无质量试剂”,无需额外添加氧化剂或还原剂,具有环境友好性与操作简便性等优势。采用电化学合成策略有望克服传统C–S键活化的缺陷,并拓展其在工业及制药领域的应用。
2023年,雷爱文课题组报道了一例烷基硫醚的阳极氧化反应:通过硫中心自由基阳离子中间体,成功实现选择性C(sp³)–S键活化,高效合成一系列有价值的不对称二硫化物(图 1b, 上)。Lundberg研究团队利用S–芳基取代基的电子特性作为电辅助基团,实现了电还原条件下选择性断裂C(sp³)–S键的新策略(图 1b, 下)。近期,Waldvogel团队采用HBr作为电解质,通过断裂C=S双键实现了杂环硫酮的阳极脱硫反应(图 1c)。
尽管化学家们已经取得了这些优异的进展,然而在电化学条件下实现杂环化合物中sp³与sp² C–S键的高化学选择性断裂的反应尚未被报道。考虑到杂环骨架的重要性以及课题组在电化学合成领域的持续探索兴趣,该文报道了一种新型的杂芳基烷基硫醚的电化学选择性C(sp³)–S/C(sp²)–S键断裂方法(图 1d)。通过精准调控反应条件,该策略可在无过渡金属条件下实现选择性脱烷基化或脱硫反应,以良好官能团兼容性合成一系列噻唑衍生物。放大实验与单通道连续流电化学合成则是进一步证明了该反应在实际有机合成中的巨大潜力。
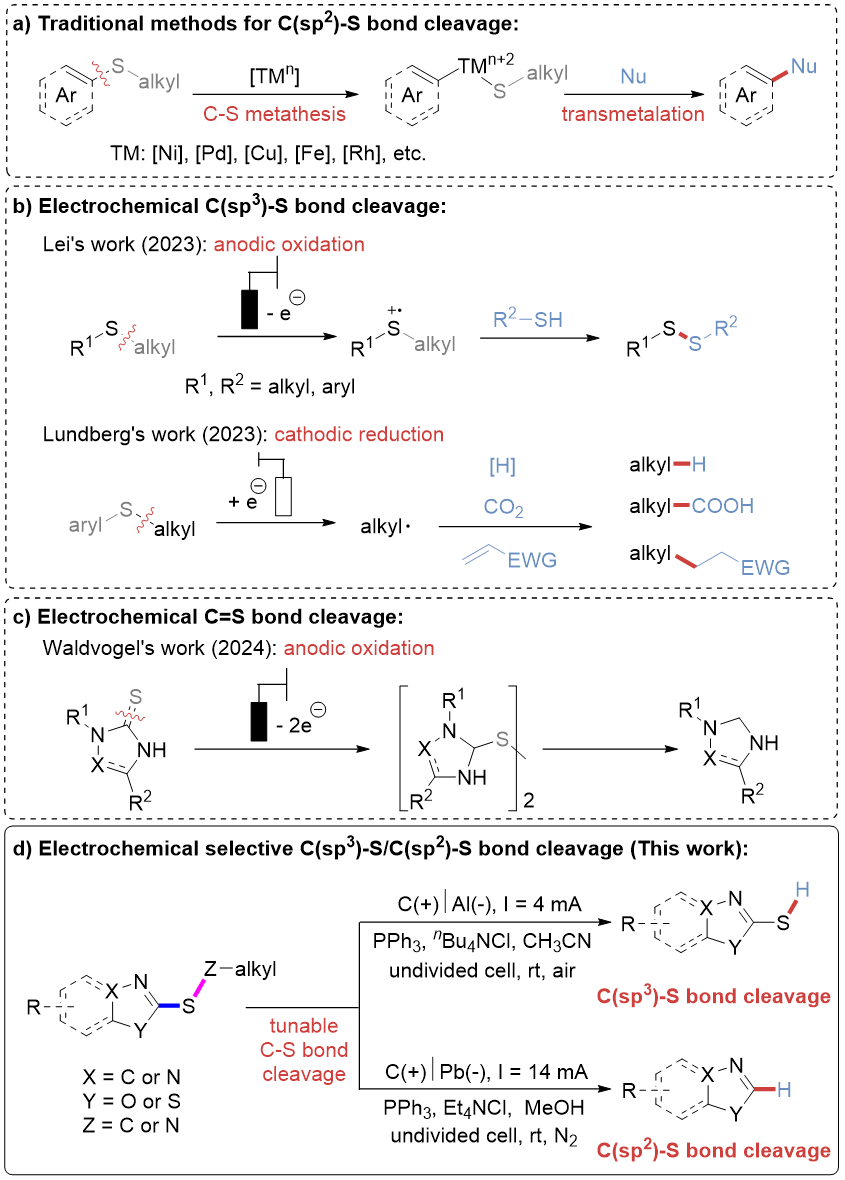
图1. C–S键/C=S断裂策略(来源:Chin. J. Chem.)
作者以2-甲硫基苯并噻唑作为模板底物对反应条件进行了筛选。实验结果表明2-甲硫基苯并噻唑在碳棒作为阳极、Al作为阴极,三苯基膦作为添加剂以及四丁基氯化铵作为电解质的电化学条件下,在室温条件下的乙腈中恒流4 mA反应4小时,可以以93%的分离收率得到脱烷基目标产物2a。而当2-甲硫基苯并噻唑在碳棒作为阳极、Pb作为阴极,三苯基膦作为添加剂以及四乙基氯化铵作电解质的电化学条件下,在氮气氛围和室温条件下的无水甲醇中恒流14 mA反应5小时,可以以82%的分离收率得到脱硫烷基目标产物3a。
在得到了最优的反应条件后,作者首先考察了该C(sp³)–S键断裂反应的兼容性(图2)。含不同硫烷基的苯并噻唑硫醚衍生物1aa-1af均表现出良好的反应性,以54%~95%收率获得目标产物2a。含氟(1ag)及活性羧基取代(1ah)的苯并噻唑衍生物同样兼容该体系。值得关注的是,被广泛用作橡胶硫化促进剂的次磺酰胺衍生物1ai-1aj同样可以在该条件下实现选择性N–S键断裂,以中等收率生成2a。苯环上含供电子基及卤取代的苯并噻唑硫醚1b-1h可转化为相应脱烷基化产物(收率52%~94%),并且不受空间位阻影响。缺电子基团(三氟甲基、氰基)取代的底物1i-1j相应的反应收率略有降低。值得注意的是,含活性羟基(1k)及氨基(1l)的底物仍可兼容于该反应并顺利转化。萘并噻唑、噻唑及4-苯基噻唑硫醚衍生物1m-1o能以68%~90%收率得到目标化合物。此外,连有多种官能团的苯并噁唑和噁二唑硫醚衍生物1p-1u均高效反应,获得相应产物。
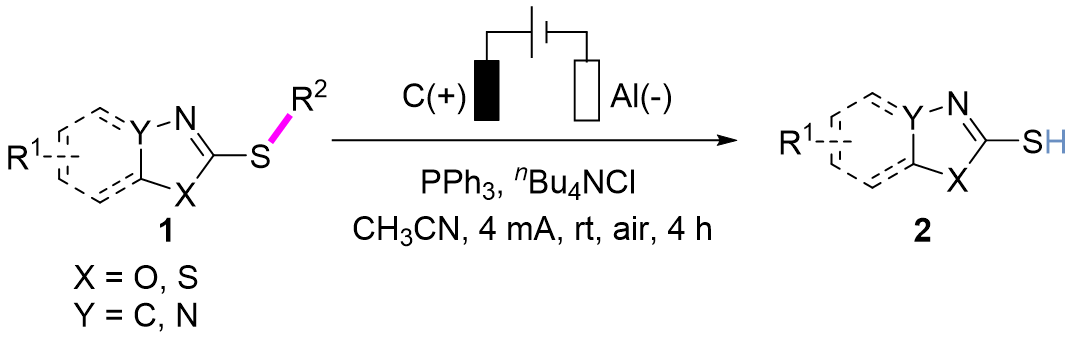
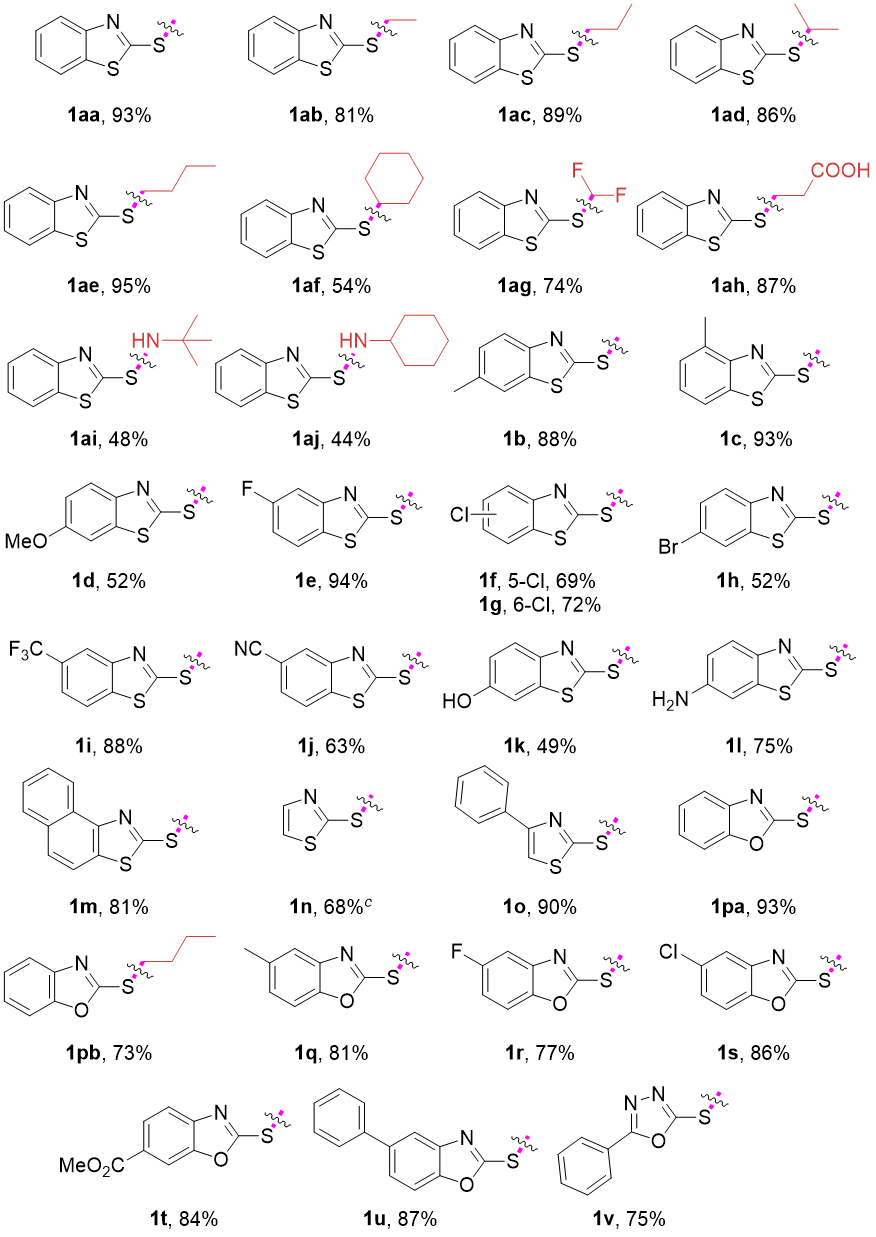
图2. C(sp³)–S与N–S键断裂底物范围研究(来源:Chin. J. Chem.)
随后作者考察了该C(sp²)–S键断裂反应的兼容性(图3),不同硫烷基的苯并噻唑硫醚均顺利转化,以44%~82%收率生成苯并噻唑产物3a。给电子基、卤素或氰基取代的底物同样能以中等收率得到目标化合物3b-3f。此外其他杂环烷基硫醚,如萘并噻唑、4-苯基噻唑、苯并噁唑衍生物均能兼容于该反应。该方法还可以用于药物分子的后修饰,例如布洛芬衍生物能高效转化为目标产物3j。
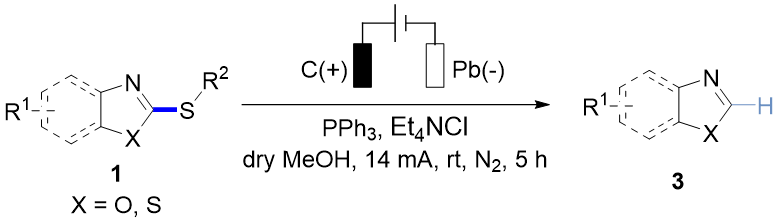
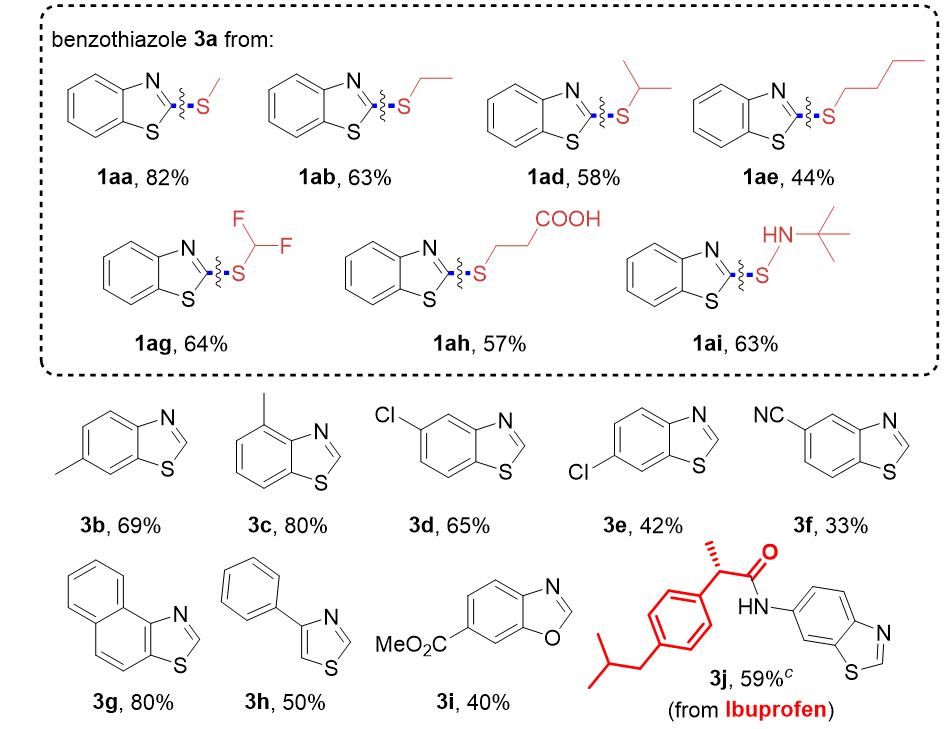
图3. C(sp²)–S键断裂底物范围研究(来源:Chin. J. Chem.)
为了探究可能的反应机理,作者进行了一系列的机理验证实验。自由基捕获实验表明反应转化中可能涉及自由基中间体(图 4A)。此外,电子顺磁共振实验也证明在C(sp³)–S键裂解过程中可能有硫自由基形成(图 4B)。循环伏安法表明随着PPh₃当量的增加,还原侧的电流密度逐渐降低,从而提高了电化学合成反应的效率。同时,PPh₃和1a的氧化峰随着PPh₃当量的增加而降低,这表明添加PPh₃可以促进反应转化(图 4C)。此外,通电/断电实验表明,在没有电流的情况下,C–S键裂解反应会停止进行(图 4D)。同位素标记实验表明甲醇或反应介质中的微量水都可能是氢源(图 4E)。
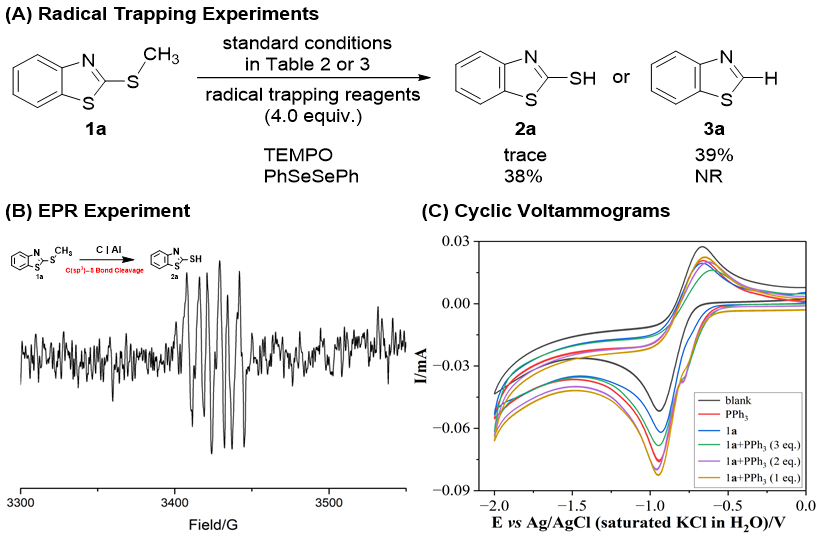
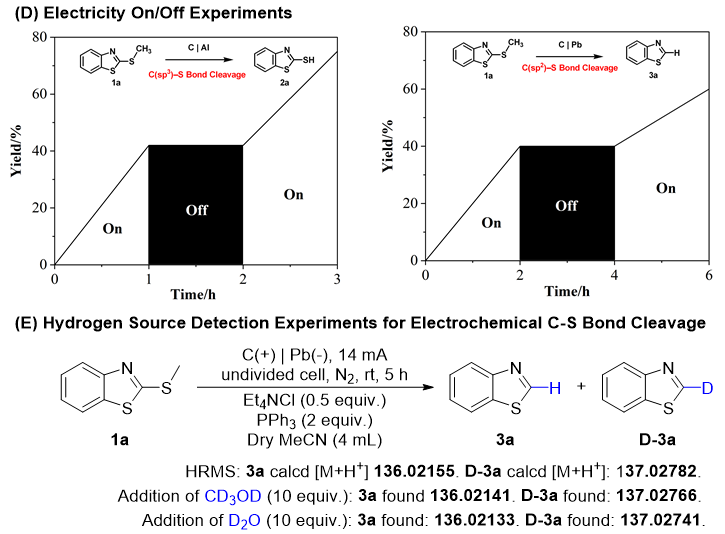
图4. 机理探究实验(来源:Chin. J. Chem.)
基于文献报道和机理探究实验结果,作者提出了可能的反应机理(图5)。对于C(sp³)–S键断裂反应:反应起始于阳极氧化生成自由基阳离子中间体II,该中间体与水反应释放出硫自由基III和甲醇。随后硫自由基III经单电子还原并质子化生成芳基硫醇产物2a。对于C(sp²)–S键断裂反应:底物1a首先在阴极还原生成自由基阴离子中间体IV,该中间体裂解产生芳基自由基V和烷基硫醇负离子VI。芳基自由基V经单电子还原并质子化生成产物3a,而烷基硫醇负离子VI通过阳极氧化二聚形成二硫化物。此外,底物1a可能与三苯基膦(PPh₃)相互作用,从而进一步活化C–S键。
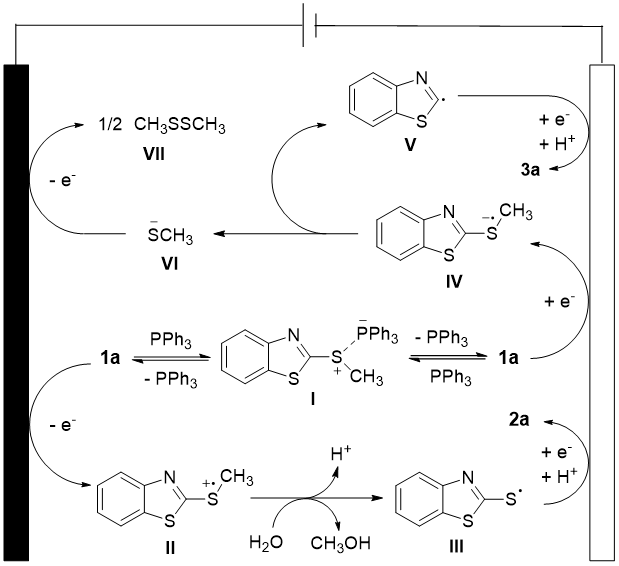
图5. 可能的反应机理(来源:Chin. J. Chem.)
综上所述,该文利用一种高效的电化学合成策略,通过选择性裂解C(sp³)−S/C(sp²)−S键,实现了无需金属催化剂的自由基介导过程。该策略能选择性实现杂芳基烷基硫化物的脱烷基化或脱硫反应,具有优异的官能团兼容性及便捷的操作流程。放大规模实验与单通道连续流电化学合成实验均证明该方法在工业领域具有巨大应用潜力。
该工作以“Electrochemical Selective C(sp³)–S/C(sp²)–S Bond Cleavage of Heteroaryl Alkyl Sulfides”为题发表在Chin. J. Chem. 上。中国计量大学庄诗怡老师、硕士研究生周方飞和新疆大学硕士研究生郜兴莲为该文共同第一作者,通讯作者为中国计量大学庄诗怡讲师、金伟伟教授和新疆大学刘晨江教授。研究工作得到了国家自然科学基金(No. 22161044)和中国计量大学科研启动经费的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




