【ACS Catal.】自由基1-(三氟甲基)环丙烷化反应的光催化方法
导读:
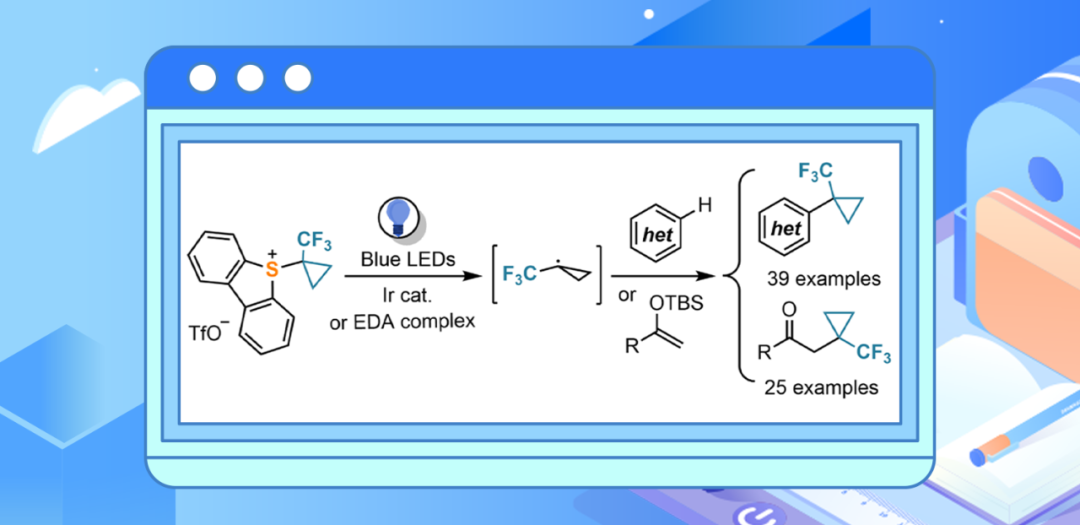
哥廷根大学(Georg-August-Universität Göttingen)Manuel Alcarazo课题组报告了一种克级合成5-(1-(三氟甲基)环丙基)二苯并噻吩三氟甲磺酸酯的简单方法。这种常温稳定试剂可在温和的光化学条件下高效释放 1-(三氟甲基)环丙基自由基,从而将这种特殊化学型直接加入(杂)芳烃和硅烯醇醚以前未官能化的位置。本文所报道的三氟甲基环丙烷化方案具有极其广泛的底物范围、显著的官能团兼容性、高区域选择性和合成收率,使该试剂特别适合制备与药物相关的组成部分。相关研究成果发表在ACS Catal.上
正文图表和简单介绍:
研究介绍:1-(三氟甲基)环丙基(TFCp)片段的使用在药物发现活动中迅速得到重视,这种日益增长的需求促进了高效合成路线的开发(Scheme 1a)。本文设想了一种新试剂,即 5-(1-(三氟甲基)环丙基)三氟甲磺酸酯 1,它有望在还原光催化条件下释放TFCp 自由基(详见Scheme 1c)。
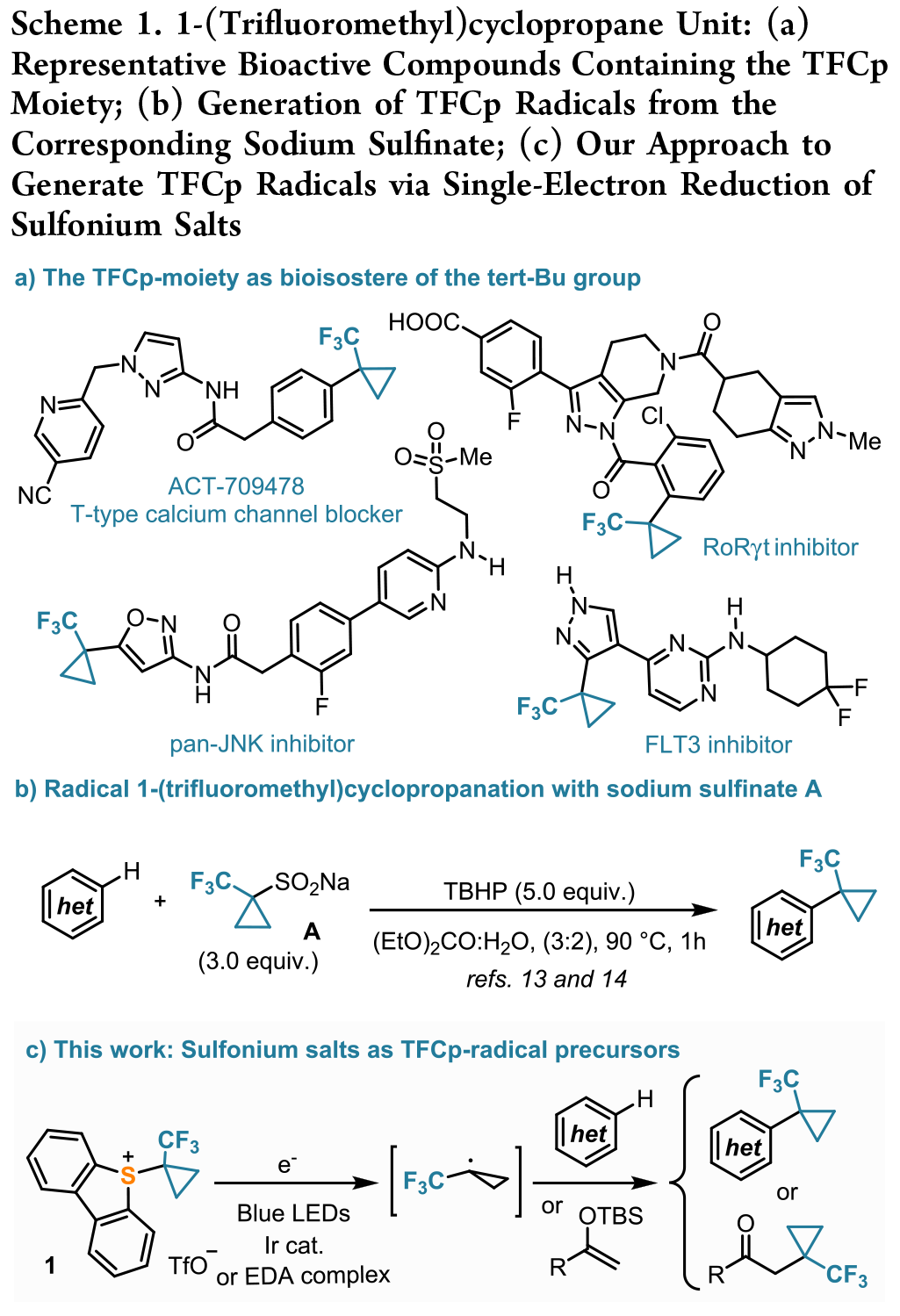
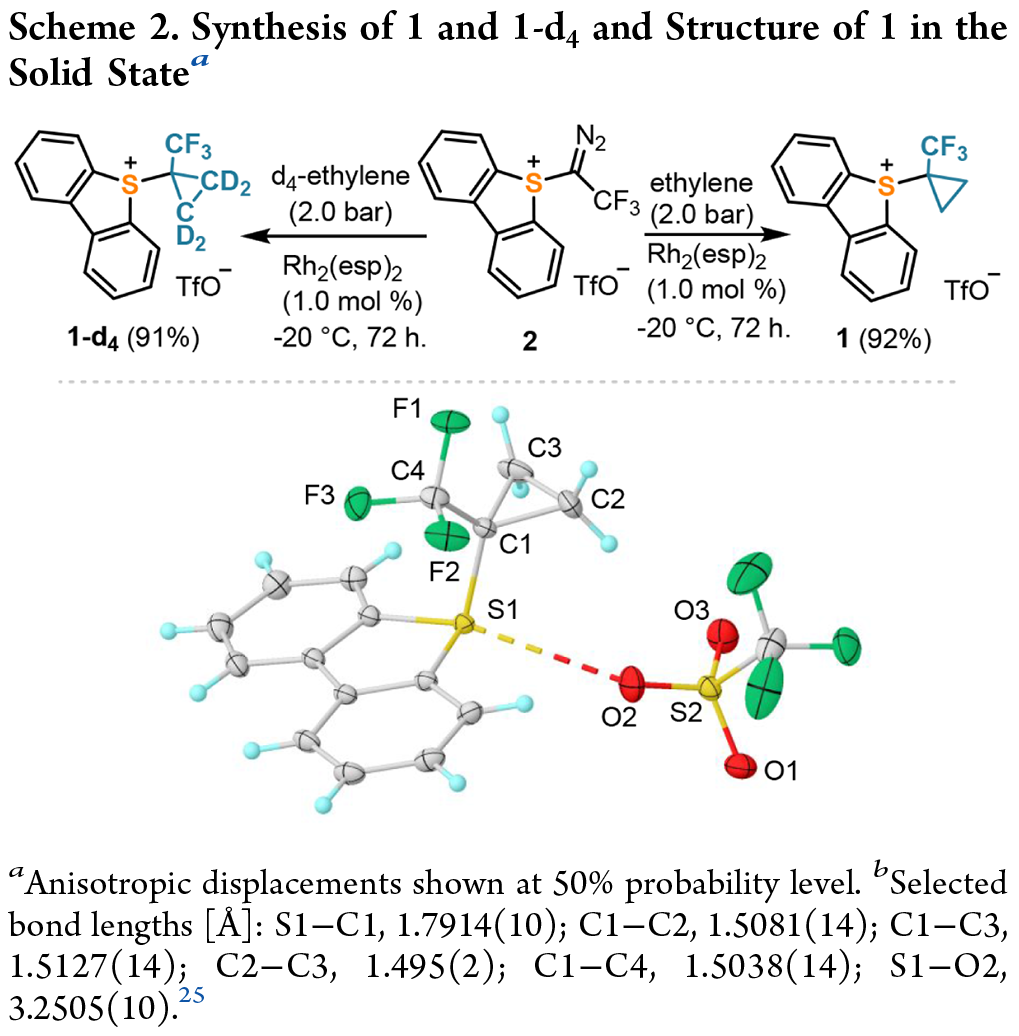
合成反应:环丙烷化反应的效果良好,反应条件是在乙烯略微超压(2.0 bar)的情况下,并且混合物必须保持在 -20 °C 以下,直到 2 完全消耗为止。向粗产品中加入二乙醚会导致1 的沉淀,从而得到分析纯度为92% 的白色粉末(Scheme 2)。
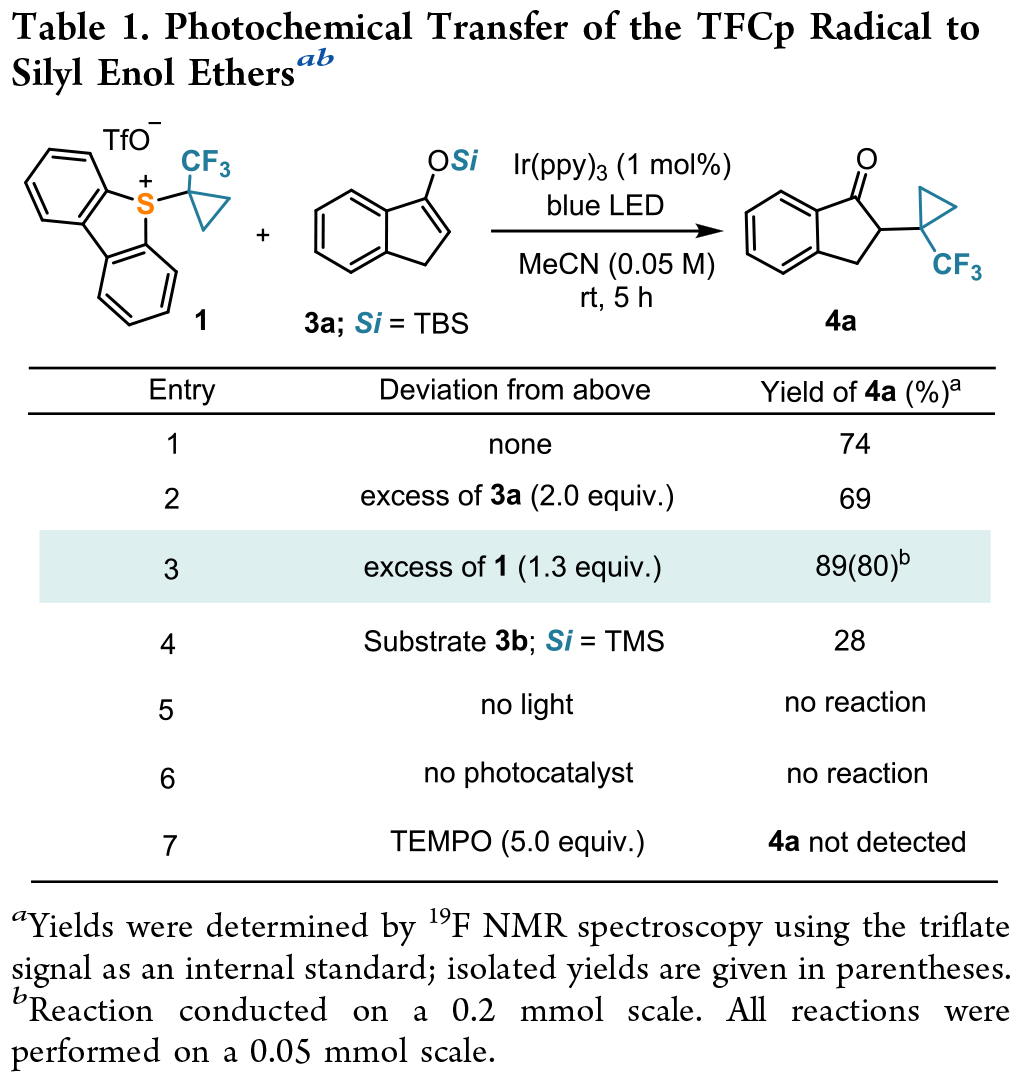
TFCp 自由基向硅烯醇醚的光化学转移(Table 1):当实验在Ir(ppy)₃ (1.0 mol %) 存在的情况下进行时,在蓝光的照射 (462 nm) 下,反应生成了所需的酮 4a,其NMR 产率为 74%。
(三氟甲基)环丙烷化反应范围(Scheme 3):展示了本文研究方法与多种结构的兼容性。
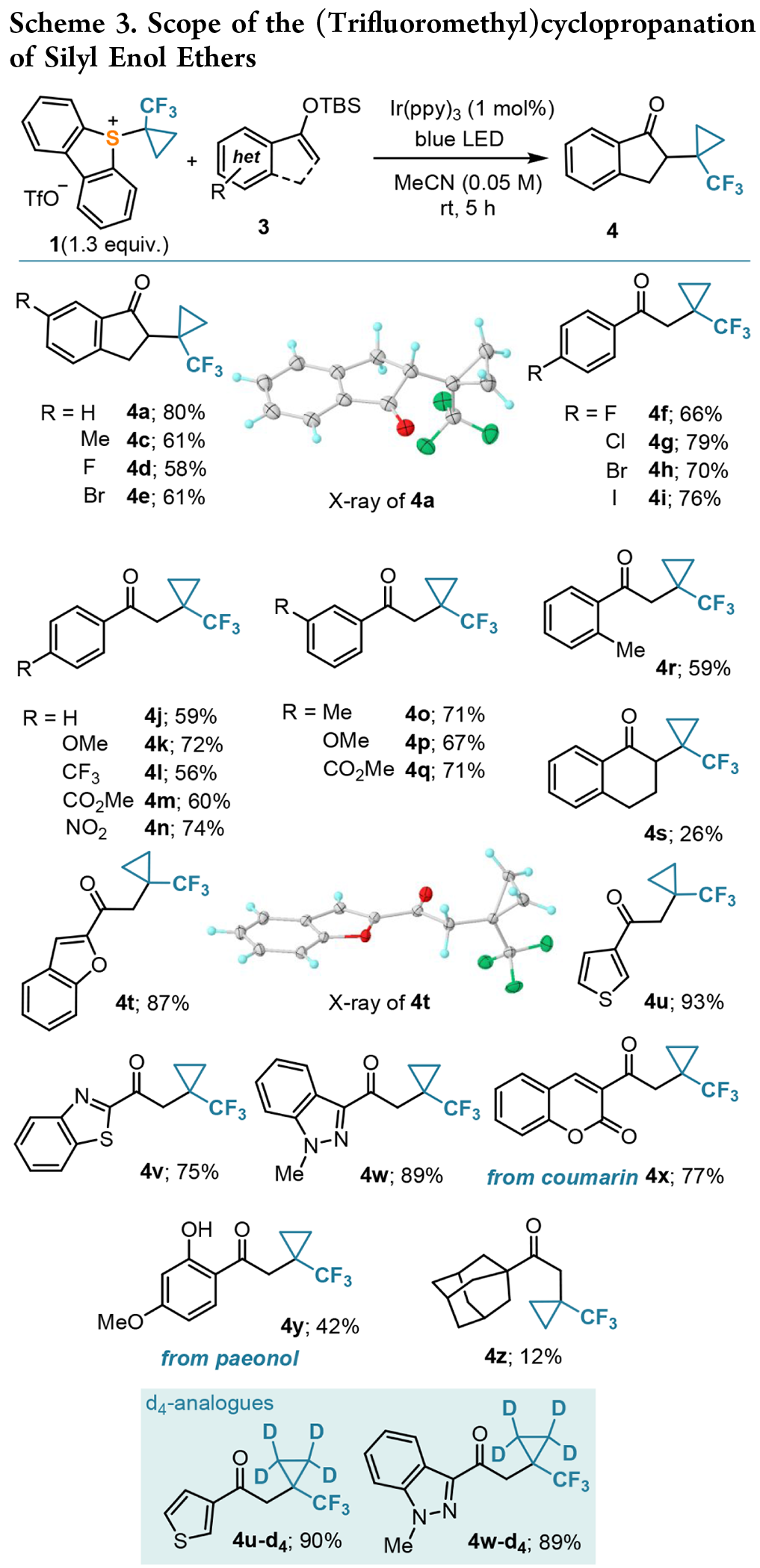
光化学环丙烷化反应:为了进一步评估上述自由基过程的范围,作者按照相同的方案尝试了喹喔啉酮的C-H 烷基化反应;N-甲基喹喔啉酮 5a 被选为优化研究的模型底物(Table 2)。最初的对照实验表明,在与 3a 的优化条件非常相似的条件下,反应以中等产率进行,加入 K₃PO₄ 来淬灭形成的三氟甲磺酸。但进一步筛选表明,底物 5a 的运行机制有所不同。
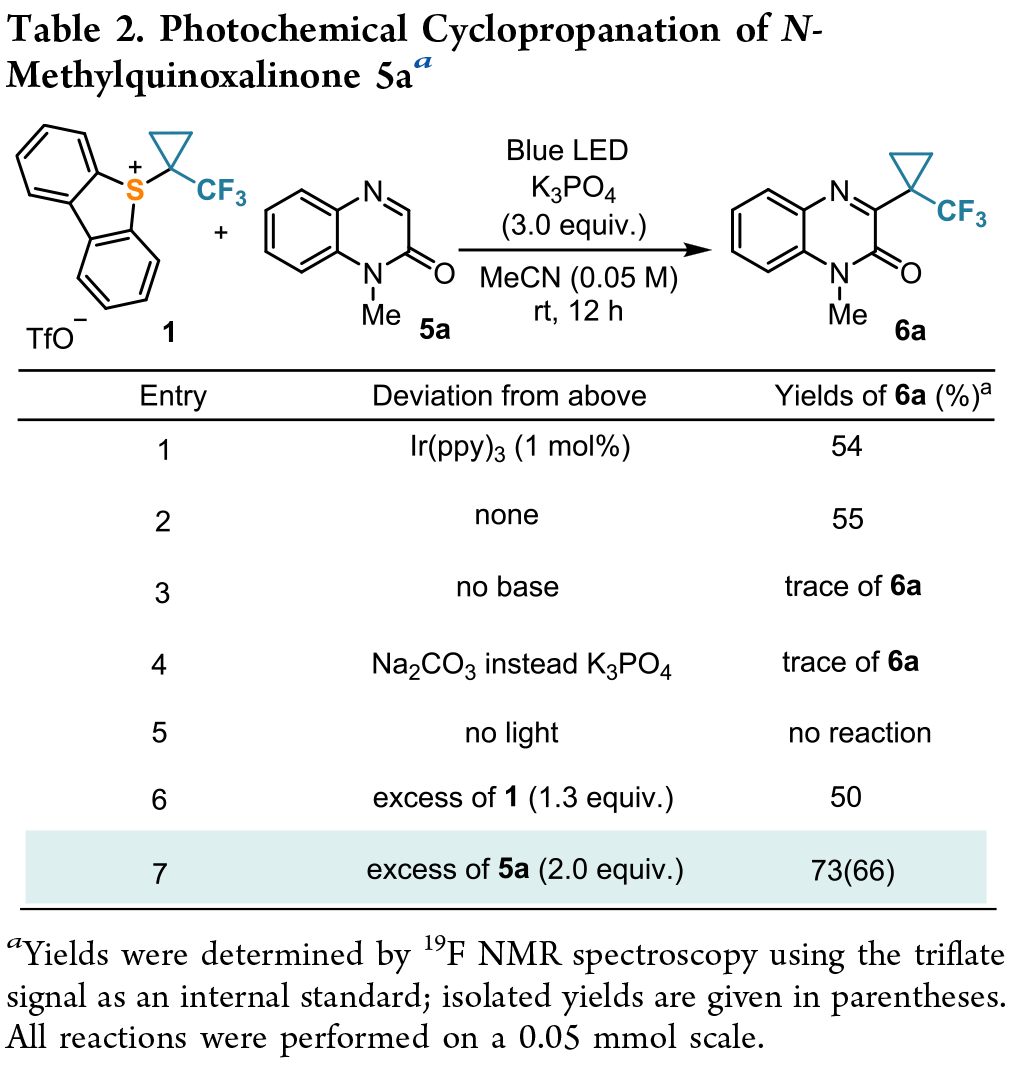
杂芳烃的(三氟甲基)环丙烷化:在喹喔啉酮底物上对这种C-H 官能化与常见取代基的兼容性进行了初步评估。卤素(6b-e,j)、末端烯烃(6h)、炔烃(6i)、酯类(6k)等物质均耐受,且收率良好(Scheme 4,conditions A)。但该方法似乎不能用于吡咯、(苯并)呋喃和(苯并)噻吩的功能化。即使反应时间延长,产量也往往很低,特别是呋喃和噻吩衍生物完全无法反应。对于这些杂环,需要使用 Ir-光催化剂(Ir(ppy)₃;1.0 mol%)(Scheme 4,conditions B)。
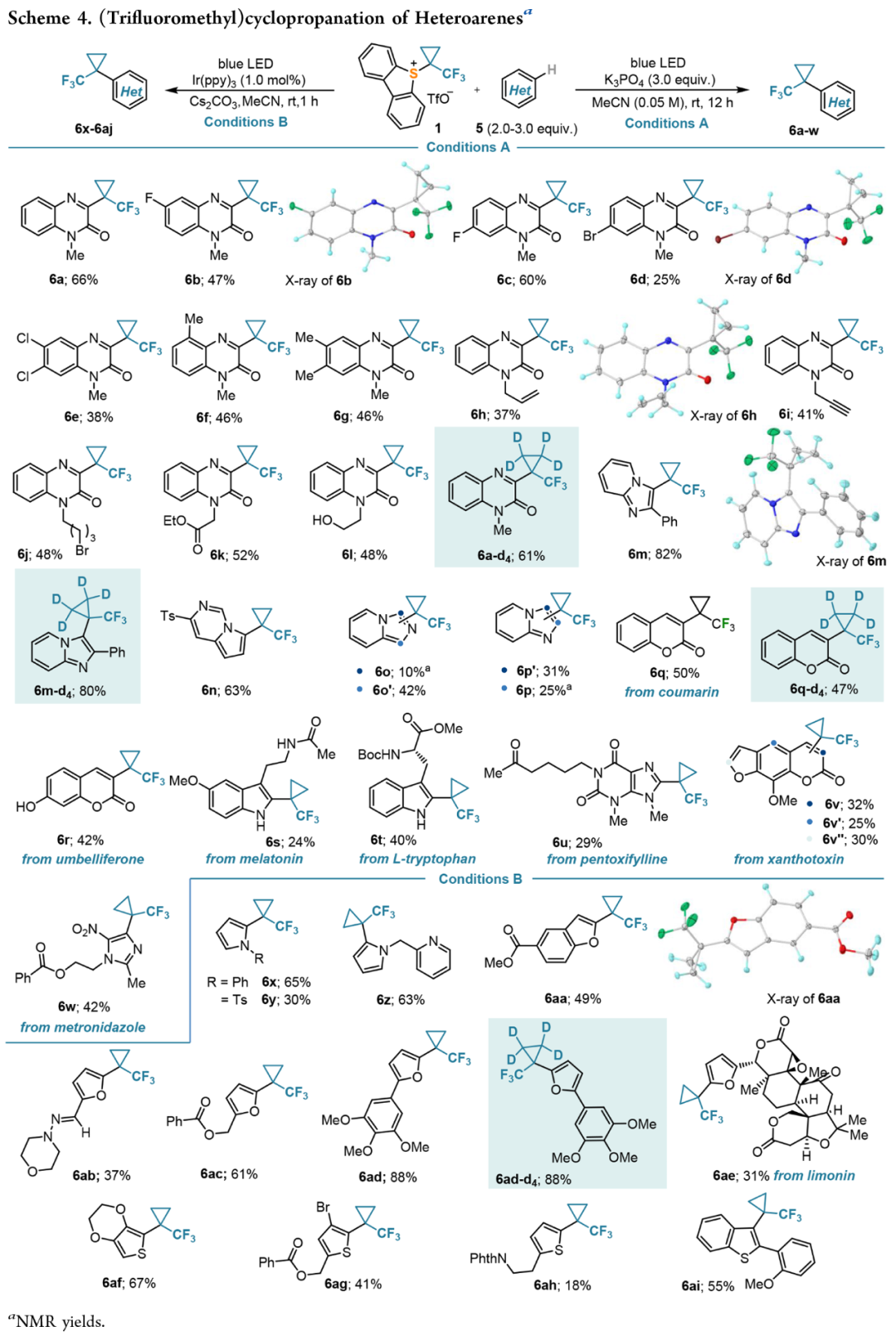
TFCp向硅烯醇醚转移的机理:进行了荧光淬灭分析(Stern-Volmer 图),在 1 的存在下,激发态的Ir-光催化剂会被有效淬灭(Scheme 5a)。使用 TEMPO 和 1,1-二苯基乙烯作为自由基捕获试剂,证实了在反应条件下 TFCp 自由基的产生(Scheme 5b)。作者提出单电子转移(SET)还原 1 导致TFCp 自由基 I 的形成,并与3a 发生反应。由此形成的中间体II 被氧化光催化剂氧化后形成碳位 III,碳位III 会坍缩成观察到的产物,同时形成TBSOTf。
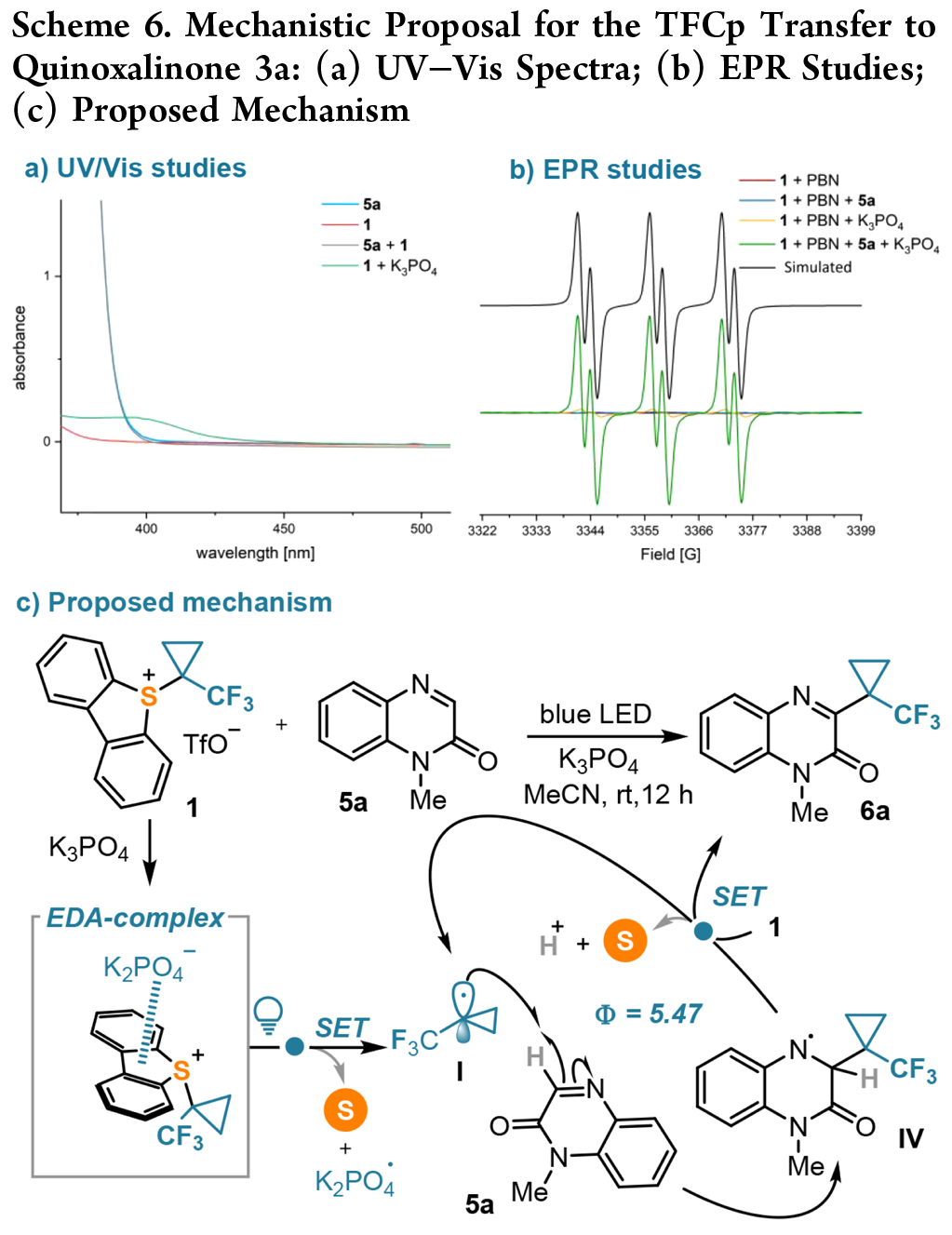
TFCp向喹喔啉酮3a转移的机理:将TFCp 有效地安装到喹喔啉酮上不需要光催化剂,这一事实表明电子供体-受体(EDA)相互作用参与了这一反应。进一步通过电子顺磁共振( EPR )光谱获得了支持光活性EDA复合物形成的证据(Scheme 6b)。根据上述实验,本文提出了以下反应机制:三氟甲磺酸酯/磷酸盐阴离子交换在锍盐 1 中形成光活性EDA 复合物,在照射时引发从磷酸盐到锍分子的 SET,产生所需的 TFCp 自由基 I 和磷酸盐自由基。I 被5a 捕获后产生自由基IV,最后将 1 还原,生成产物6a,并重新生成I。从IV 到磷酸盐自由基的氢原子转移可能是自由基链的最后一步。
(图片来源:ACS Catal.)
论文信息
Sven Timmann, Moritz T. H. Dilchert, Jörg Dietzel, Verena S. Pöltl, Marc R. Wennekamp, Christopher Golz, Manuel Alcarazo*. A Photocatalytic Approach to Radical 1-(Trifluoromethyl)cyclopropanation. ACS Catal., 2025
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




