【OL】广西大学李伟宇/中山大学周磊课题组:光催化/碱促进脱氟串联环化合成单氟环己烯和6-氟-1,2,3,4-四氢吡啶衍生物
氟原子选择性引入药物分子可提高其代谢稳定性,并改变其物理性质和生物活性。单氟烯烃作为酰胺类药物的稳定生物电子等排体,是药物化学中的重要结构单元(图1A,1B),也是合成其他氟化化合物的关键中间体。目前的方法主要集中于非环状单氟烯烃的合成,而高度官能化的单氟环烯烃的合成仍然具有挑战性,特别是通过通用方法同时构建六元碳/氮杂环单氟烯烃。
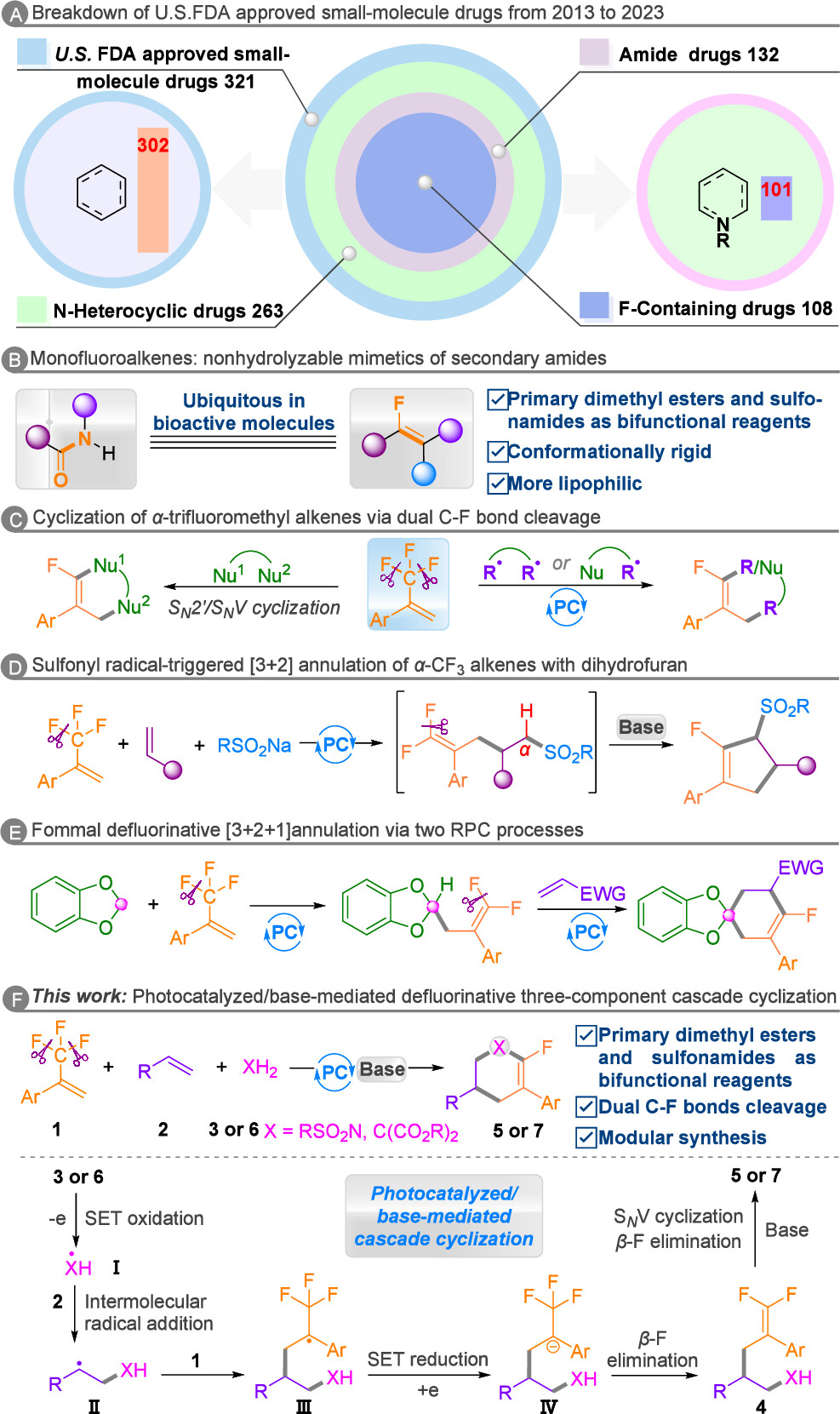
图1. 研究背景及本文策略(来源:Org. Lett.)
近日,广西大学李伟宇/中山大学周磊课题组合作报道了α-CF3烯烃、未活化烯烃和二甲酯或磺胺类化合物通过双C-F键裂解的三组分级联环化反应。首先,以三氟甲基烯烃1a、丁基乙烯基醚2a和丙二酸二甲酯3a为模板底物进行条件优化。结果表明,以乙腈为溶剂可完全抑制两组分副产物4a'的生成;当K2CO3用量减少至1.0当量时,三组分产物4a的收率显著提升至95%。随后,在光反应完成后,真空除去过量的3a和溶剂,以2.0当量Cs2CO3为碱,于DMSO中70℃下进行碱介导的SNV环化反应2小时,即可以80%的产率生成单氟环己烯5a。底物普适性研究显示(图2),芳环上具有不同电性和空间效应的取代基,以及杂环取代的α-CF3烯烃均能顺利参与反应;对于未活化烯烃,无论是末端烯烃、内烯烃还是环状脂肪烯烃,均表现出良好的反应性(图3)。进一步将丙二酸二甲酯替换为磺酰胺类化合物后,各种类型的α-CF3烯烃和富电子烯烃均能顺利反应;此外,源自天然产物(如胆固醇和D-葡萄糖)的乙烯基醚也可兼容该反应,且磺酰胺底物不限于芳香族化合物(图4)。
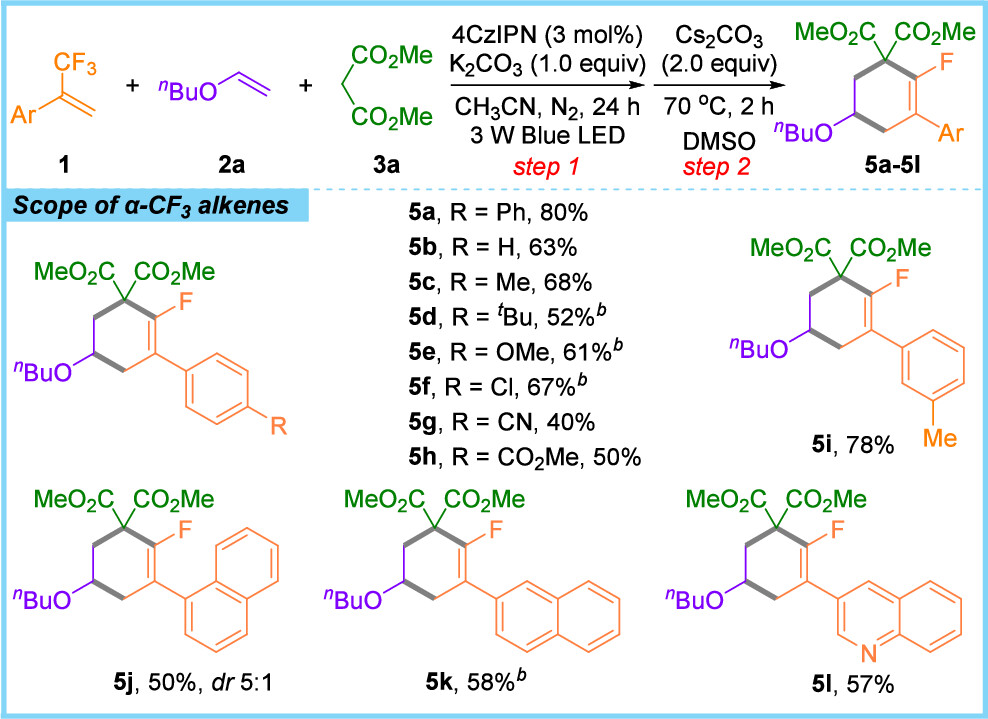
图2. α-CF3烯烃底物拓展(来源:Org. Lett.)

图3. 富电子烯烃底物拓展(来源:Org. Lett.)
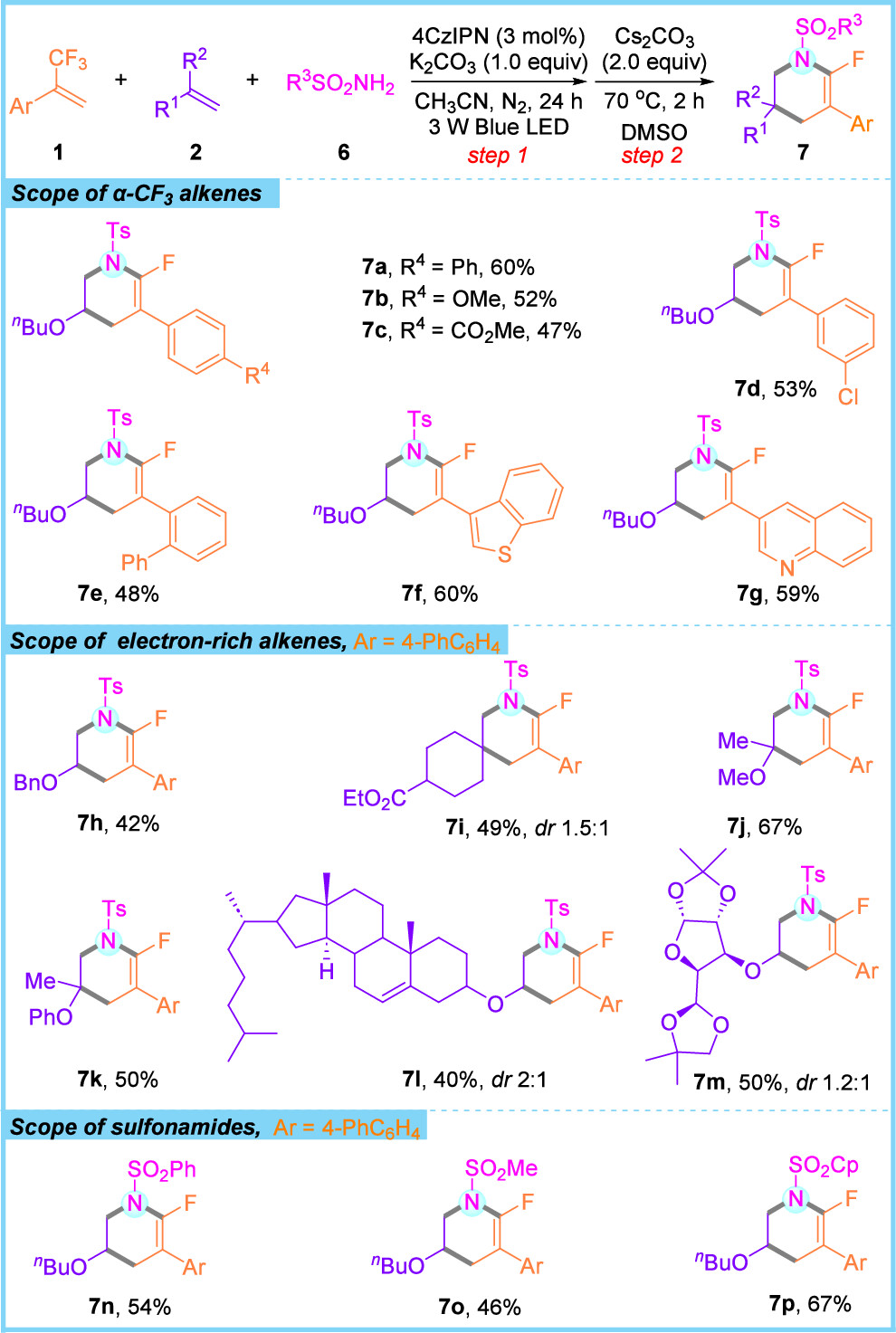
图4. 磺酰胺底物拓展(来源:Org. Lett.)
此外,将反应规模放大至5 mmol,单氟环己烯5a仍可保持70%的产率。产物5a可作为合成砌块,进一步用于多种转化(图5):包括酯基的选择性脱除、与尿素或丙酮的环化反应、还原环化反应,以及化合物7a的脱磺酰基和氧化脱氟反应。
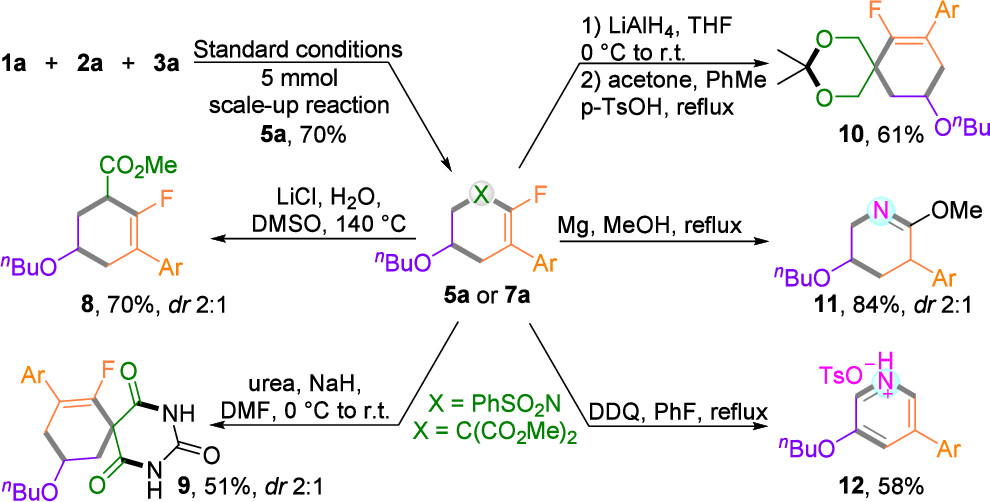
图5. 5 mmol规模合成及应用转化(来源:Org. Lett.)
为探究反应机理,作者进行了一系列机理实验(图6)。结果表明:偕二氟烯烃4a可通过分子内SNV环化以93%产率转化为5a,但在光氧化还原条件下,分子内自由基环化难以进行;光催化下加入TEMPO抑制了4a生成,并检测到(2-丁氧乙基)丙二酸二甲酯-TEMPO加合物;(-)-β-蒎烯的自由基开环实验以95%产率得到偕二氟烯烃13。基于此,作者提出如下机理(图7):在光激发态4CZIPN*和碱作用下,双功能试剂(丙二酸酯或磺酰胺)经SET氧化生成自由基中间体I,继而与不同烯烃连续进行极性匹配的自由基加成生成中间体III,III再经SET还原和β-氟消除得到偕二氟烯烃4,最终经碱介导的SNV环化得到单氟环己烯5或四氢吡啶7。
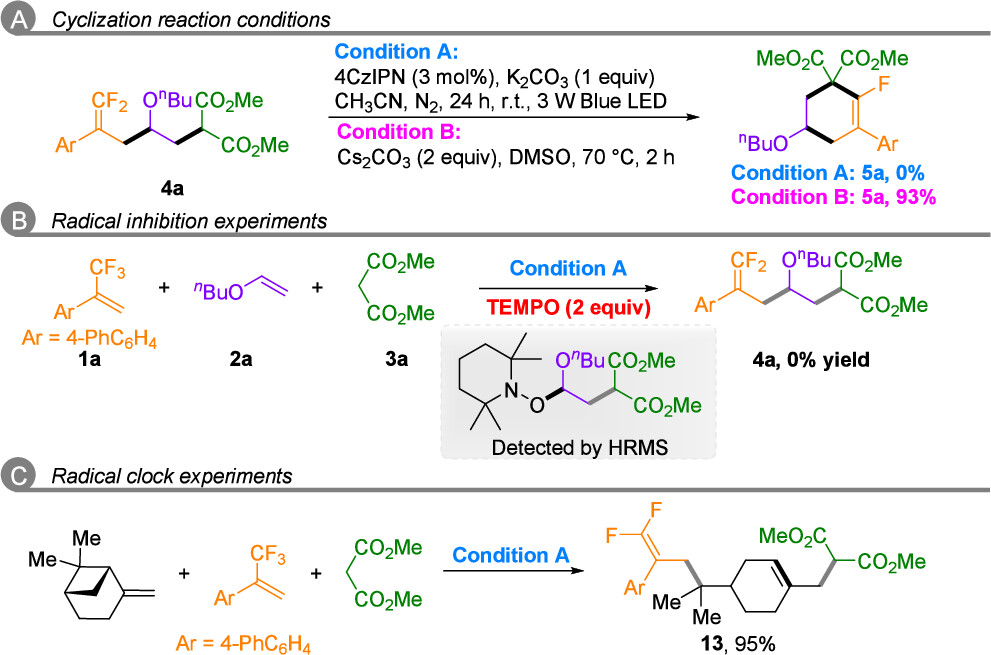
图6. 机理研究 (来源:Org. Lett.)
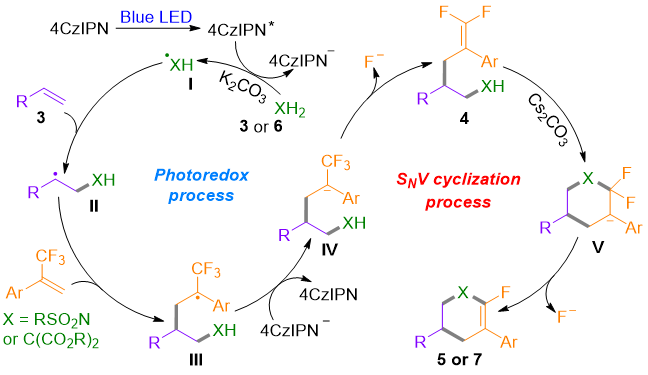
图7. 可能的反应机理(来源:Org. Lett.)
综上所述,该论文报道了一种光催化/碱介导的连续脱氟三组分串联环化反应,以磺酰胺或丙二酸酯作为双功能碳/氮源(兼具自由基和亲核特性),实现了单氟环己烯和6-氟-1,2,3,4-四氢吡啶的高效合成。该方法条件温和、通用性强,可通过模块化组装,由易得的α-CF3烯烃和富电子烯烃出发,构建两类重要的含氟药物结构,且所得产物官能团丰富,可进行多种后续转化。
这一研究成果近期发表在Org. Lett.上(DOI: 10.1021/acs.orglett.5c00675),广西大学李伟宇与中山大学周磊为论文的通讯作者,广西大学硕士研究生张姝玥为论文的第一作者。该研究得到了广西大学启动资金等项目的支持。




