【JACS】上科大黄焕明课题组:光钯催化实现1-氮杂双环[n.1.1]烷烃的自由基区域选择性合成

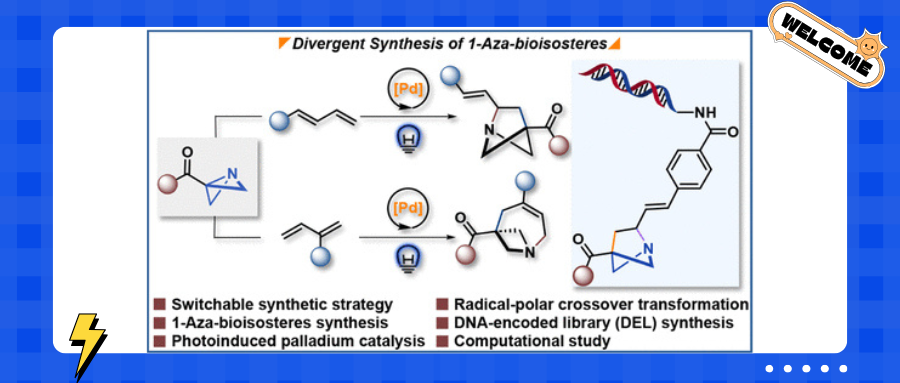
吡啶是上市药物中第二常见的环状体系,近些年来,在“escape from flatland”概念的推动下,三维氮杂生物电子等排体已成为药物化学中吡啶环的有力替代结构,并引发了众多科研工作者的关注(图1A)。在之前的工作中,2-氮杂生物电子等排体和3-氮杂生物电子等排体已经有了较多的报道,然而,1-氮杂双环[2.1.1]己烷(1-aza-BCHs)的合成路线仍然很少,开发1-aza-BCH温和且广泛的合成方法则成为了值得探讨的研究热点。
应变释放化学的发展为生物电子等排体的合成提供了有效的解决方法。而由氮杂双环[1.1.0]丁烷(ABB)转化为1-氮杂双环[2.1.1]己烷(1-aza-BCHs) 的方法却未得到充分开发,仅有少量报道的工作。
上海科技大学黄焕明课题组使用ABB作为自由基前体,在可见光照射下,光激发的钯催化剂与激活的 ABB反应,生成稳定的α-酮自由基,与1,3-二烯进行区域选择性加成(图1 C)。形成的烯丙基钯中间体与氮中心阴离子发生选择性亲核进攻,最终实现区域选择性发散的1-氮杂双环[2.1.1]己烷和1-氮杂双环[4.1.1]辛烯这两类氮杂生物电子等排体的合成。
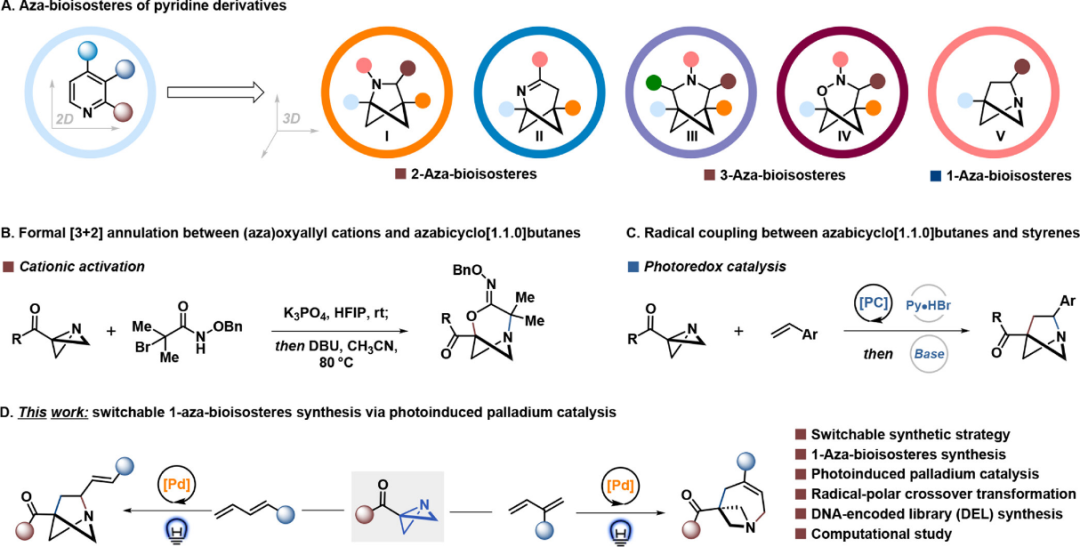
图 1 氮杂生物电子等排体的合成策略。
(图片来源:J. Am. Chem. Soc.)
作者使用ABB 1a和 1,3-二烯2a为模型底物,Pd(PPh3)4作为催化剂,MeCN作为溶剂,在水冷光反应器中对光诱导Pd催化合成1-aza-BCH进行条件优化。优化发现温度对反应收率有极大影响,将温度升高到 60°C 可以显著提高反应性,可能是由于亲核攻击增强所致(图2,entry 2)。增加光子通量也可以进一步提高收率:光强度为 1 W/cm2和 1.3 W/cm2 时产率分别提高到 47%(图2,entry 3)和 71%(图2,entry 5)。使用高沸点的溶剂也可显著提高产率。作者还筛选了其他Pd催化剂及用量、光催化剂、光源、时间、碱、溶剂等,并对照实验证实了钯、配体、LiBr 和 K2CO3以及高光子通量光对高产率的必要性。
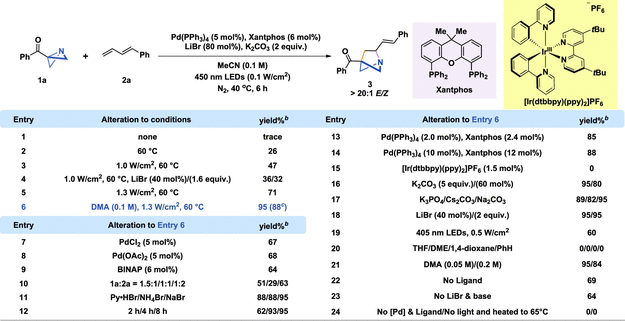
图 2 1-aza-BCHs的条件筛选。
(图片来源:J. Am. Chem. Soc.)
在确定最佳反应条件后,作者研究了底物适用性,构建了各种1-aza-BCHs(图3)。对于芳基取代的ABB衍生物,无论是吸电子取代基,还是给电子基团,都能表现出良好的反应性,得到相应产物的产率为40–92%。带有噻吩和呋喃取代基的 ABB 也可以成功转化为产物。此外,线性烷基ABB和环状烷基ABB也都能与当前的催化体系兼容,目标产品的产率可达44–85%。对于1-芳基-1,3-二烯,带有吸电子基团和给电子取代基也都能表现出良好的反应性,产率为69%~92%。该方法对杂芳烃和稠合芳烃取代的二烯基团仍然适用,产物产率可达71%至87%。此外,烷基取代的二烯和多取代的二烯体系也成功转化为所需产物,证明了该方法的广泛适用性。
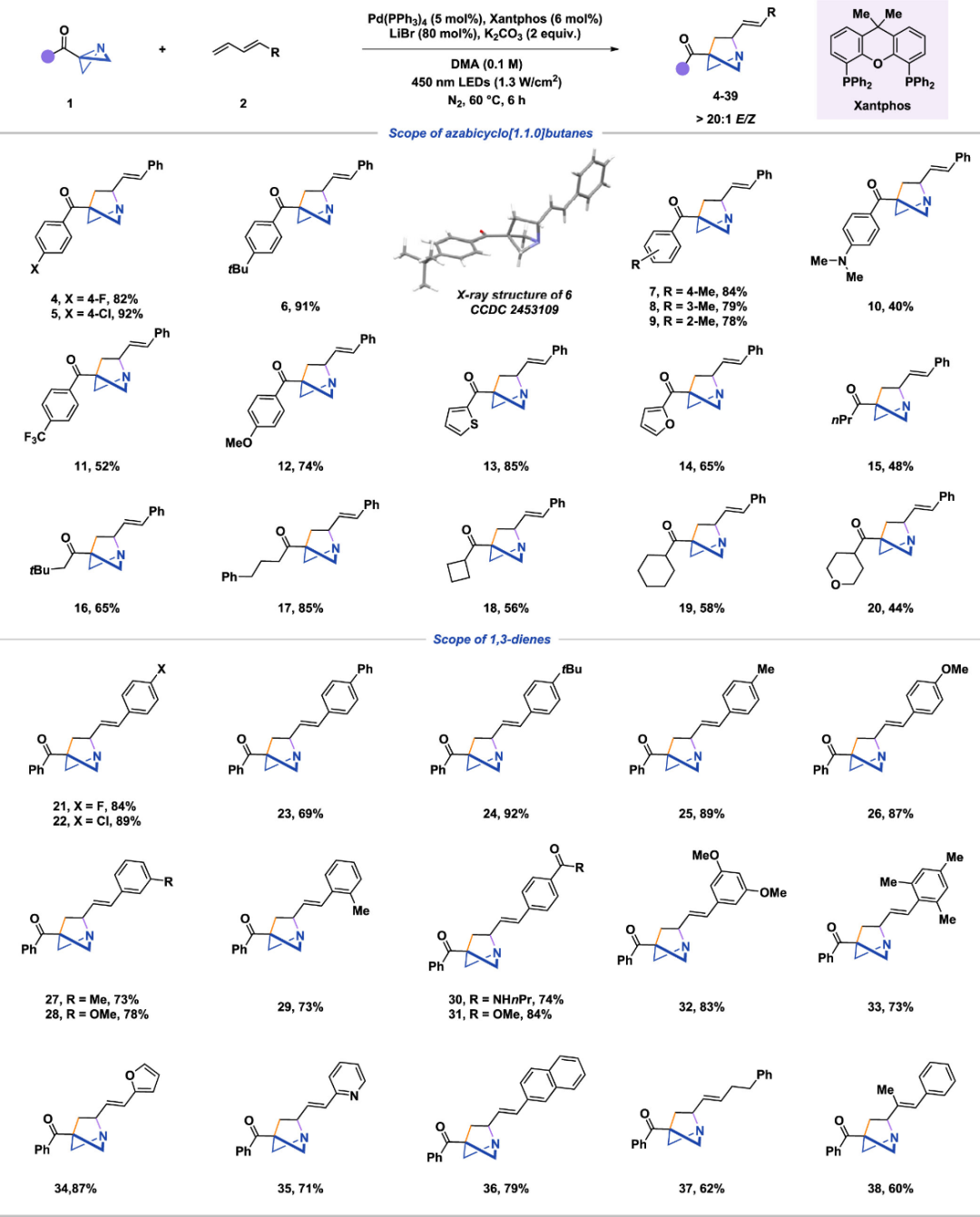
图 3 1-aza-BCHs的底物拓展表。
(图片来源:J. Am. Chem. Soc.)
在优化1-aza-BCHs合成的基础上,作者观察到用2-芳基-1,3-二烯取代1-芳基-1,3-二烯会形成含有1-氮杂双环[4.1.1]辛烯和1-氮杂双环[2.1.1]己烷的混合物,比例为 2.7:1(图4)。通过配体筛选,作者发现烷基双齿膦配体L4能够以优异的化学选择性生成产物1-氮杂双环[4.1.1]辛烯(图4,entry 1)。进一步优化表明,用碘离子代替溴离子(图4,entry 2&3),再加上增加化学计量当量,可以显著提高反应收率。
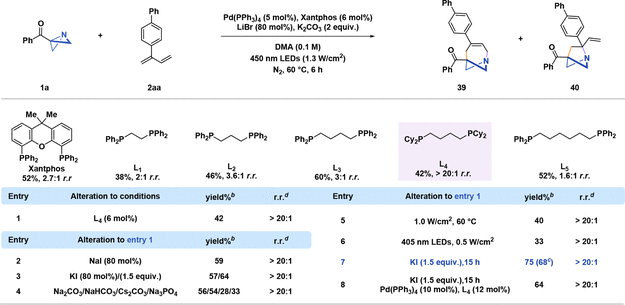
图 4 1-氮杂双环[4.1.1]辛烯的条件筛选。
(图片来源:J. Am. Chem. Soc.)
作者对 1-氮杂双环[4.1.1]辛烯的合成同样进行了全面的底物研究(图5)。该反应与吸电子取代/给电子取代芳基取代的ABB,都能在当前的催化条件下得到产物。杂芳族体系也可表现出良好的相容性值得注意的是,烷基取代的ABB和环烷基ABB表现出优异的性能,产率为62%至93%。在 2-芳基-1,3-二烯底物的研究中,各种芳香族和脂肪族取代通常可得到产物,产率为中等至优异。
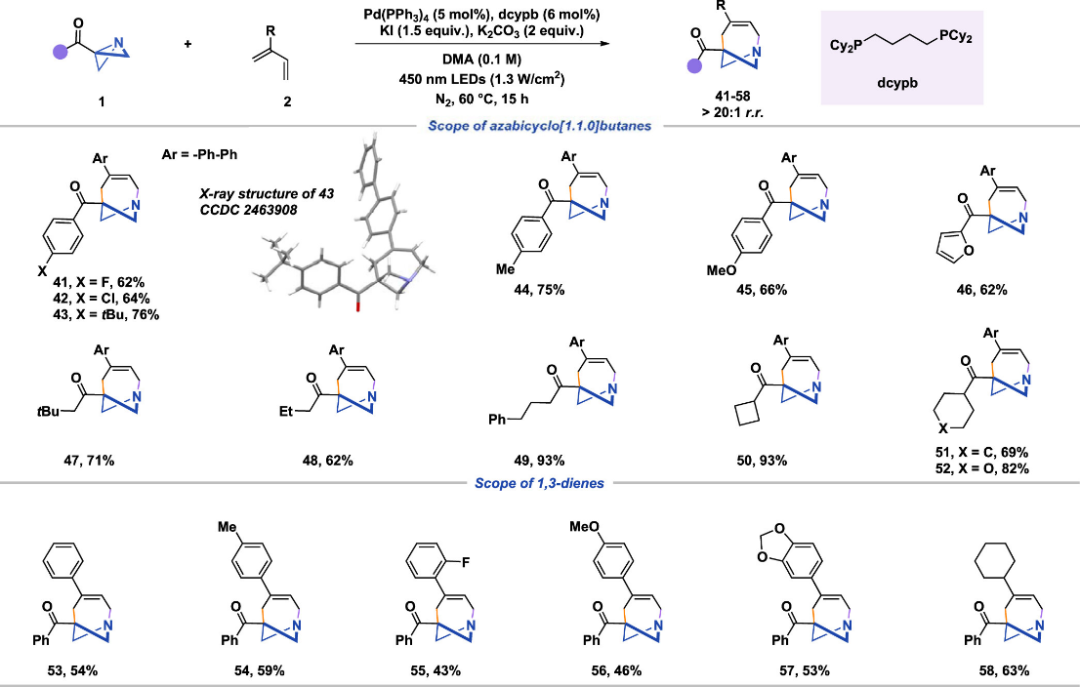
图 5 1-氮杂双环[4.1.1]辛烯的底物拓展表。
(图片来源:J. Am. Chem. Soc.)
为了证明该方法的实际适用性,作者进行了4.5 mmol规模的克级反应,得到了棕色油状所需产物3,分离产率为 86%(1.12 g),并进行了衍生化(图6 A)。不仅如此,作者进一步将该方法扩展到DNA编码化合物库(DEL)的合成(图6 B)。通过酰胺缩合将1,3-二烯与DNA头段连接的胺基末端结合,在温和的反应条件下成功实现了1-氮杂双环[2.1.1]己烷的掺入DNA的合成策略。该方法能够与多种ABB高效偶联,从而能够将双环结构精准地安装到DNA骨架上,从而拓展DNA编码库的结构多样性。
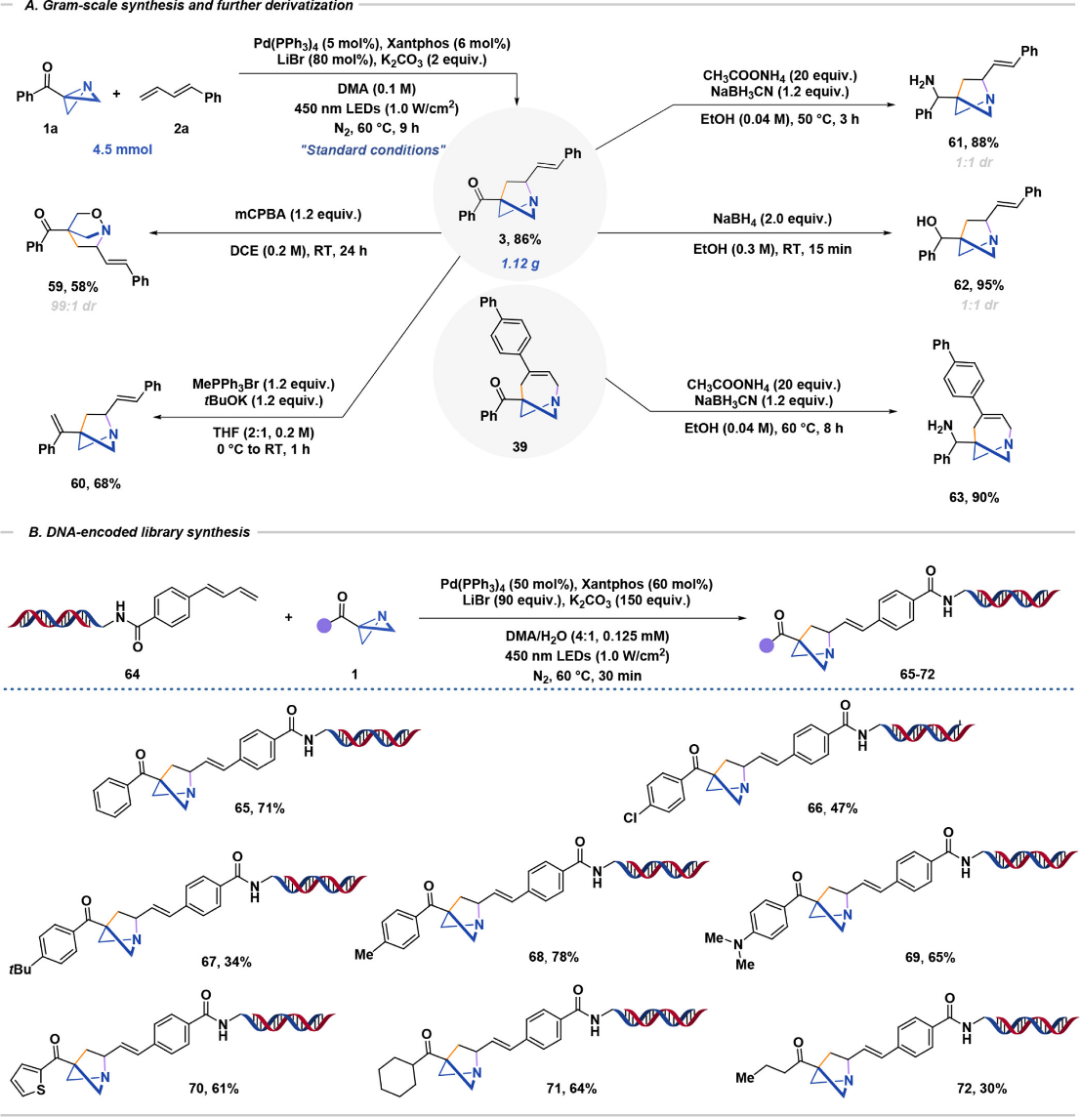
图 6 克级反应,衍生化和DEL编码库。
(图片来源:J. Am. Chem. Soc.)
最后,作者进行了机理探究(图7)。作者TEMPO进行自由基抑制实验,产物的形成被完全抑制(图7 A,上)。用2-((苯磺酰基)甲基)丙烯酸甲酯捕获,得到自由基加合物,证实了自由基中间体II的存在(图7 A,向下)。使用含环丙烷的二烯在标准条件下反应,可以得到开环产物,证明发生了自由基开环。卤代中间体经标准条件反应也能以58%收率得到产物,证明底物ABB和LiBr原位生成卤代物参与反应。利用PBN捕获的EPR实验进一步验证了该机理(图7 D)。以上结果表明反应过程中生成了α-羰基自由基II。紫外可见吸收分析表明Pd(PPh3) 4在反应波长(450 nm)处有光吸收,从而证实了Pd(PPh3) 4作为本体系中有效的光催化剂被光活化(图7 E)。此外,结合我们的机理研究,Stern–Volmer 猝灭研究表明,钯催化剂仅被烷基溴化物I猝灭。
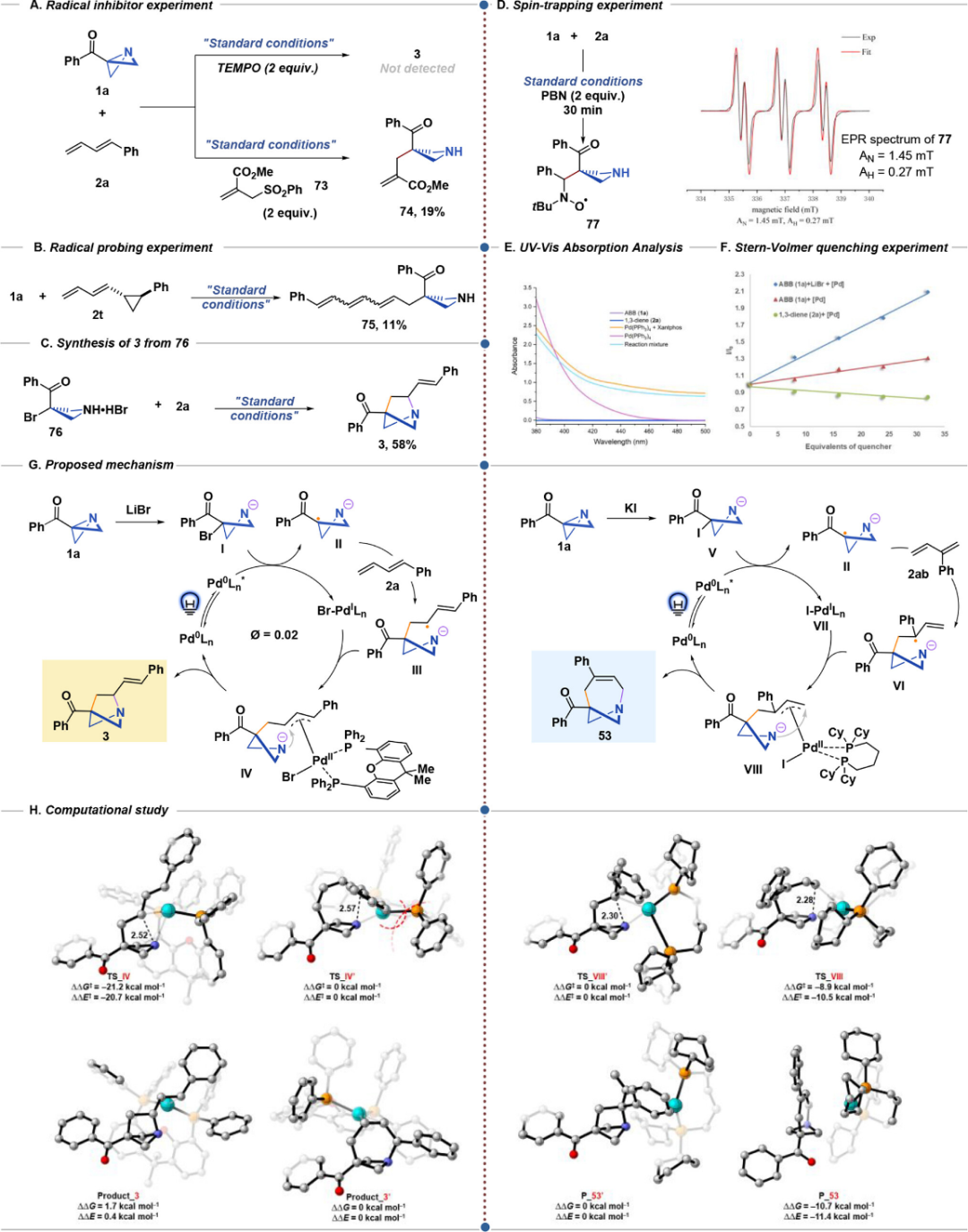
图 7 机理探究与DFT计算。
(图片来源:J. Am. Chem. Soc.)
作者基于机理探究的结果提出了该反应可能的反应机理(图7 G):在可见光条件下,ABB 和LiBr原位生成溴化物中间体I,通过光激发钯催化剂进行单电子还原,在可见光条件下形成α-羰基自由基II。随后被1,3-二烯捕获,生成烯丙基自由基III,与Pd(I)结合生成 π-烯丙基 Pd(II) 中间体IV。然后,IV中的氮阴离子进行分子内亲核进攻,生成 1-氮杂双环[2.1.1]己烷产物3(图7 G,左)。或者,当使用KI时,碘化物中间体V形成并被还原为氮杂环丁烷基自由基阴离子II。在2-取代的1,3-二烯的作用下,该途径通过烯丙基自由基VI和Pd(I)物种生成中间体VIII ,最终通过分子内环化得到1-氮杂双环[4.1.1]辛烯衍生物(图7 G,右)。密度泛函理论(DFT)研究证明,反应的选择性通过配体和底物间的空间位阻控制。
该工作提供了一种新型可见光驱动的钯催化方法,以常见的ABB前体为原料,通过配体与底物间的位阻效应,区域选择性发散地合成两类不同的含氮生物电子等排体。该方法使用自由基-极性交叉催化体系,展现出了卓越的合成实用性,不仅推动了三维氮杂环的合成,而且为选择性自由基化学和生物电子等排体设计的未来发展提供了有力的策略支撑。
该研究成果近期发表在Journal of the American Chemical Society(JACS)上,黄焕明教授为唯一通讯作者,上海科技大学为第一通讯单位。该研究工作得到了国家自然科学基金和上海科技大学启动金的资助。
论文信息:
Divergent Synthesis of 1-Azabicyclo[n.1.1]alkane Bioisosteres via Photoinduced Palladium Catalysis
Ying Zhang, Kai-Dian Li, Song Yu, Kangyin Pan, Hongtao Xu, and Huan-Ming Huang*
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




