【ACS Catal.】黄素光催化酚的苄位官能团化、螺环化及螺环环氧化反应

近日,德国雷根斯堡大学Burkhard König与印度理工学院Debayan Sarkar团队开发了一种光催化方法,可直接从简单的酚类前体原位生成对亚甲基苯醌化合物(para-Quinone methides,p-QMs),从而避免了对苄位预官能团化或过渡金属试剂的需求。光生成的p-QMs可高效转化为:苄位官能团化产物、螺环化产物及螺环环氧化产物,快速构建苄基骨架与结构复杂的富含sp³-杂化碳的螺环骨架。此外,该策略的合成实用性通过在药物及天然产物的后期官能团化中得到进一步验证。相关研究成果发表在ACS Catal.上。
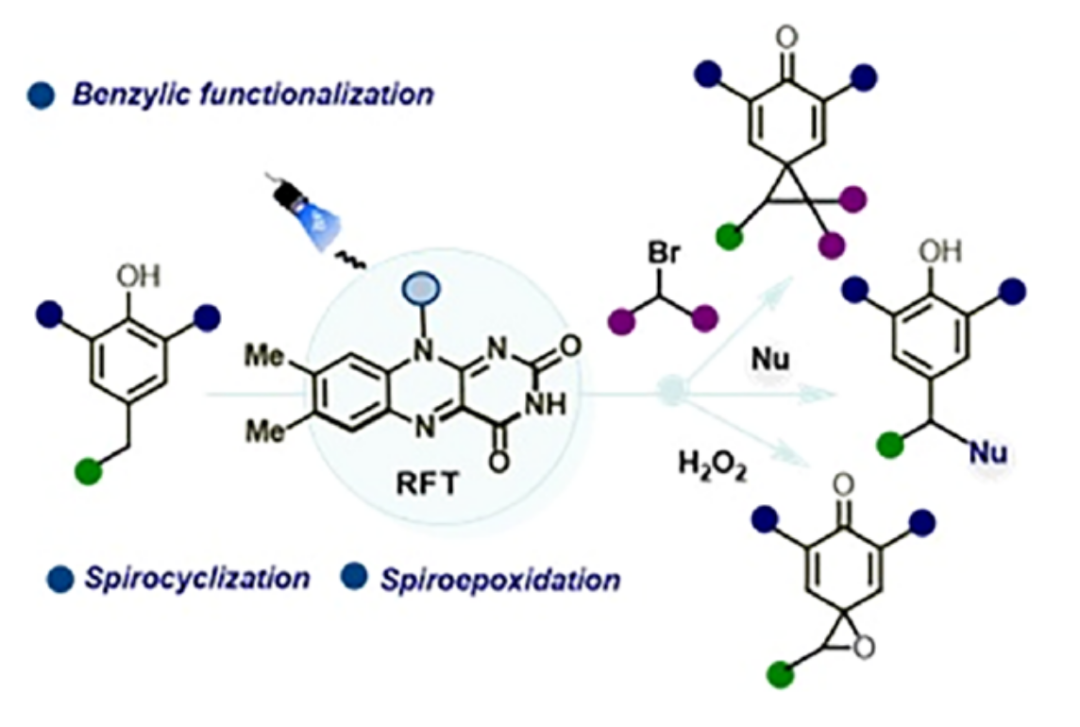
(来源:ACS Catal.)
酚类是至关重要的官能团,在天然产物化学与合成方法学中占据核心地位。其广泛可得性、低廉成本及化学性质多样性,使酚类成为不可或缺的合成砌块、有机起始原料,更是制备农用化学品、药物分子及功能材料的关键前体。更重要的是,酚类也是构成激素、抗生素、维生素与神经递质等生物活性分子的核心结构。鉴于其广泛用途,酚类衍生物的高效合成及后续官能团化研究对工业界和学术界均具重大意义。其中,邻亚甲基苯醌(o-QMs)与对亚甲基苯醌(p-QMs)是一类特别重要的瞬态去芳构化中间体,其衍生自酚类化合物。由于其兼具中性非芳香性与两性离子芳香性的独特性质,这些瞬态中间体表现出独特的化学反应活性,使其在生物过程和合成有机化学中均可作为关键的亲电中间体。传统上,邻亚甲基苯醌(o-QMs)主要通过以下途径原位生成:经烷基酚的热分解(热致β-消除)、氧化脱氢(化学或光化学方式)或酸/碱促进的β-消除反应。2025年,吴骊珠团队报道了一种无金属可见光诱导的合成方法:通过邻烷基苯酚类化合物的可见光介导氧化反应生成邻亚甲基苯醌(o-QMs),并进一步与烯烃发生环加成反应,以优异产率获得苯并二氢吡喃类化合物。相比之下,传统原位生成p-QMs的方法存在两大局限:其一需在苯酚的对位苄位引入离去基团(LG),其二需依赖化学计量的重金属通过单电子转移(SET)破坏芳环的芳香性,这极大限制了其应用范围。为了解决上述的问题,德国雷根斯堡大学Burkhard König与印度理工学院Debayan Sarkar团队开发了一种光催化方法,可直接从简单酚类前体原位生成p-QMs,从而避免了对苄位预官能团化或过渡金属试剂的需求。
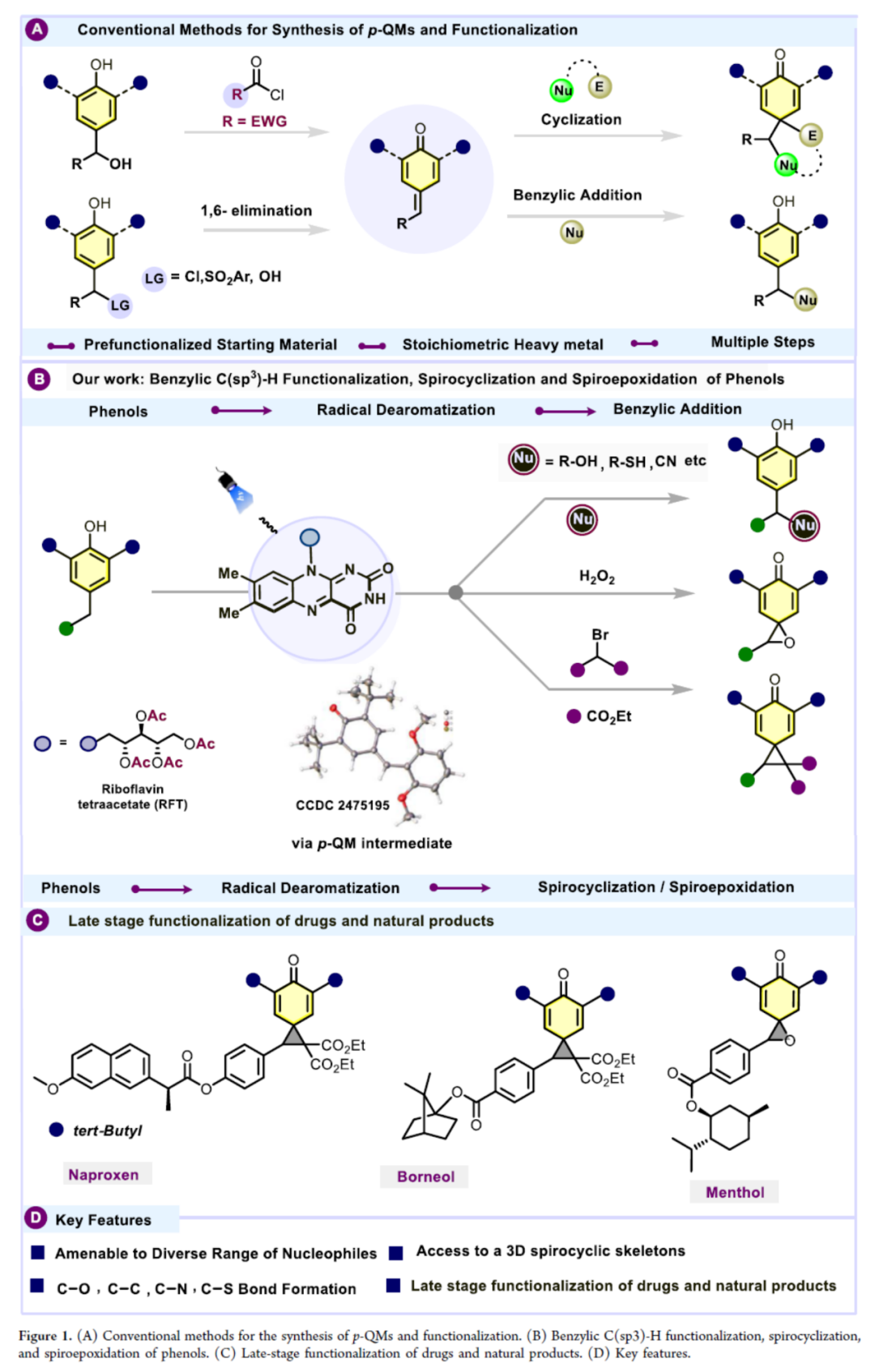
(Figure 1,图片来源:ACS Catal.)
首先,作者以2,6-二叔丁基-4-乙基苯酚(1a)作为模型底物,对反应条件进行了大量的筛选(Table 1)。筛选结果表明,当以核黄素四乙酸酯(RFT)作为光催化剂,蓝色LEDs(λmax=451 nm)作为光源,MeOH作为亲核试剂,MeCN作为溶剂,在室温下反应,可以86%的收率得到产物2a。
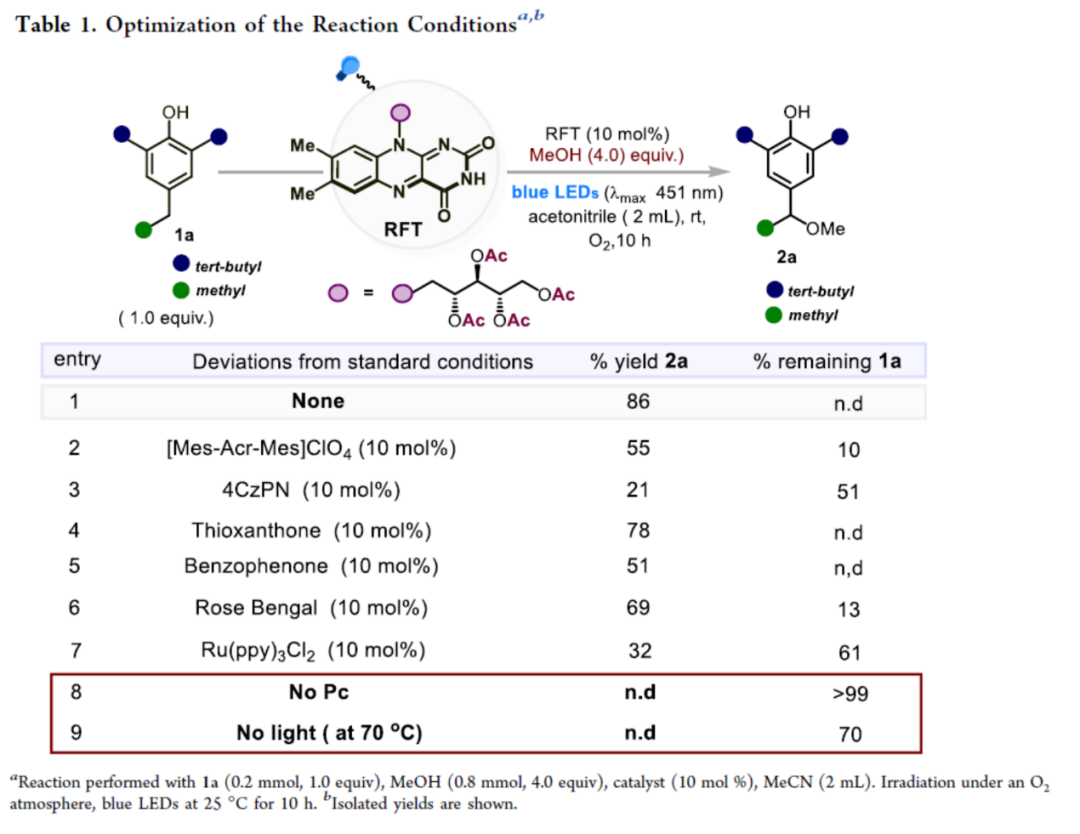
(Table 1,图片来源:ACS Catal.)
在获得上述最佳反应条件后,作者对亲核试剂的范围进行了扩展(Scheme 1)。首先,一系列一级醇与二级醇,均可顺利进行反应,获得相应的产物2a-2k,收率为64-88%。环丙基与环丁基取代的醇,也是合适的底物,获得相应的产物3a(收率为59%)和3b(收率为73%)。同时,不同电性取代的苄醇,也能够顺利进行反应,获得相应的产物4a-4e,收率为77-92%。其次,芳基、杂芳基与烷基取代的硫醇,也与体系兼容,获得相应的产物5a-5e和6a-6c,收率为61-81%。此外,各种含氮的杂芳基化合物,均可顺利进行反应,获得相应的产物7a-7g,收率为59-89%。值得注意的是,该策略还可用于天然产物的后期衍生化,获得应的产物8a-8c,收率为71-77%。
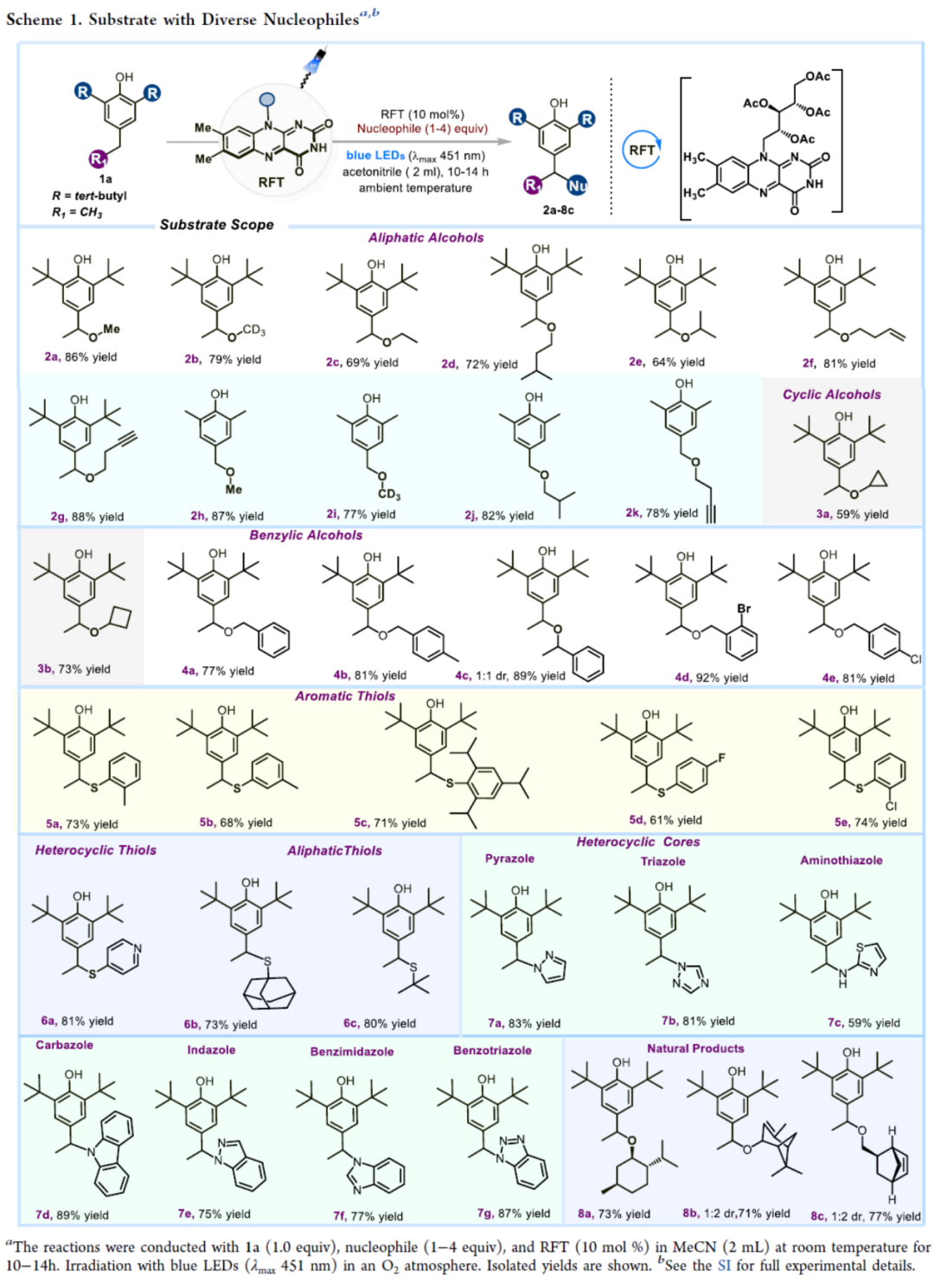
(Scheme 1,图片来源:ACS Catal.)
紧接着,作者对螺环化及螺环环氧化反应的底物范围进行了扩展(Scheme 2)。在优化的条件下(CS2CO3/RFT),多种对位取代的酚类化合物以及噻吩基取代的酚类化合物,均可顺利进行反应,获得相应的螺环产物9a-9i,收率为69-87%。值得注意的是,该策略还可用于药物与生物活性分子的后期衍生化,如萘普生、吉非贝齐、布洛芬、衍生物、薄荷醇和冰片衍生物,获得相应的产物10a-10e,收率为51-88%。此外,通过对反应条件的再次优化后(H2O2/KOH/Et3N/RFT),成功实现了螺环环氧化反应,获得相应的螺环环氧化产物11a-11c,收率为73-91%。
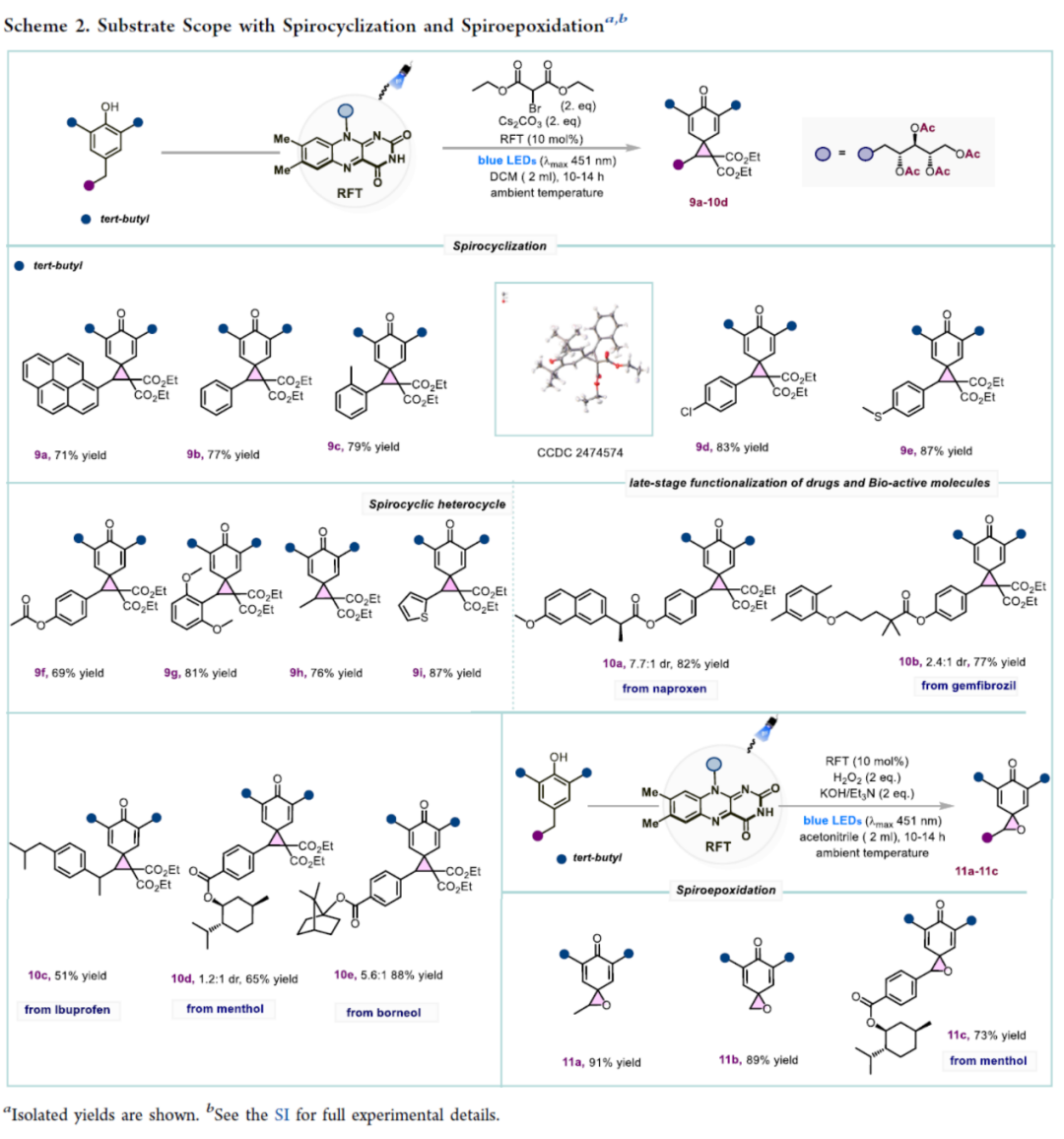
(Scheme 2,图片来源:ACS Catal.)
此外,原位形成的对亚甲基苯醌化合物(p-QMs)还可参与多种转化(Scheme 3)。首先,当使用3-氯戊烷-2,4-二酮作为亲核试剂时,反应形成了C−C键,获得相应的产物12a-12c,收率为70−95%。化合物1a与三甲基硅基叠氮化物(TMSN3)发生苄位叠氮化反应,可以71%的收率生成苄基叠氮化物13a。其次,当以硝基甲烷和水作为亲核试剂时,也观察到类似的转化反应,分别以77%和81%的收率得到苄位硝基芳烃产物14a和取代苄醇产物15a。此外,1a还可与TMSCN发生氰化反应,可以88%的收率得到α-芳基腈产物16a。
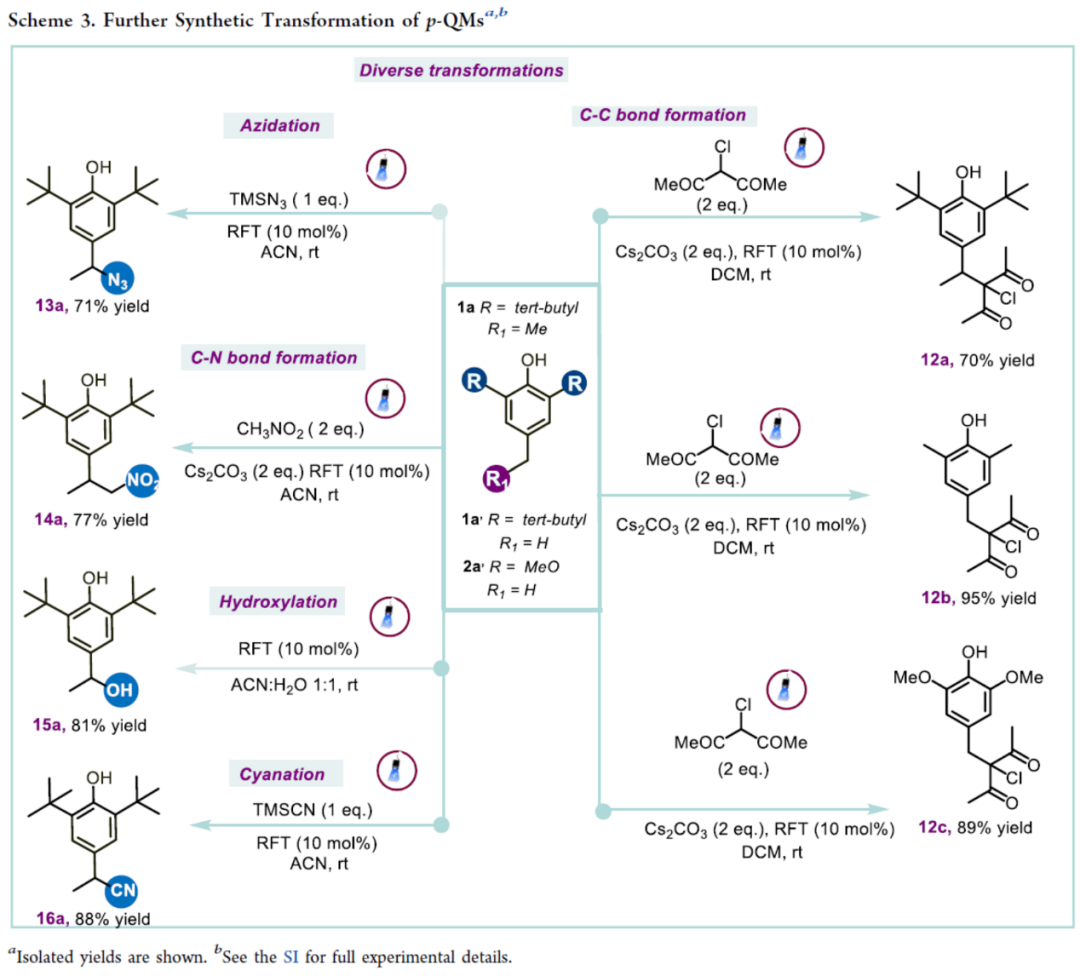
(Scheme 3,图片来源:ACS Catal.)
最后,作者对反应的机理进行了研究(Figure 2)。首先,紫外-可见光谱(UV/vis)分析表明,光催化剂RFT是451 nm波长处唯一的光吸收物种,且光催化剂PC与底物1a之间不存在基态相互作用(Figure 2A)。其次,通过测量反应混合物在DPA存在条件下的吸光度变化(λmax = 355 nm)发现,短波长处的吸收降低,这可能归因于DPA通过[4+2]环加成反应与反应中产生的单线态氧反应,导致其π-共轭体系被破坏(Figure 2B)。通过对RFT与化合物1a的1:1混合物进行随时间变化的紫外-可见光谱分析发现,观察到325 nm与280 nm处存在两个明显的等吸光点,表明1a向2aa的转化过程单一且彻底,反应中未出现显著中间体累积(Figure 2C)。此外,控制实验结果表明,氧气在反应中起着关键作用(Figure 2D)。基于上述的研究以及相关文献的查阅,作者提出了一种合理的反应机理(Figure 2E)。首先,该反应由RFT的光激发引发,产生单线态激发态(1RFT*),其经系间窜越(ISC)形成三线态(3RFT*)。其次,光催化剂的三线态与分子氧(3O2)发生能量转移,生成高活性单线态氧(1O2)。单线态氧从底物1a攫取氢原子,形成苯氧自由基中间体1aa和氢过氧自由基1bb。氢过氧自由基(1bb)继续攫取第二个氢原子,生成p-QM中间体2aa和过氧化氢(H2O2)。值得注意的是,p-QM中间体2aa在反应条件下表现出足够的稳定性。最后,p-QM中间体2aa在亲核试剂存在下发生再芳构化,从而得到目标产物。
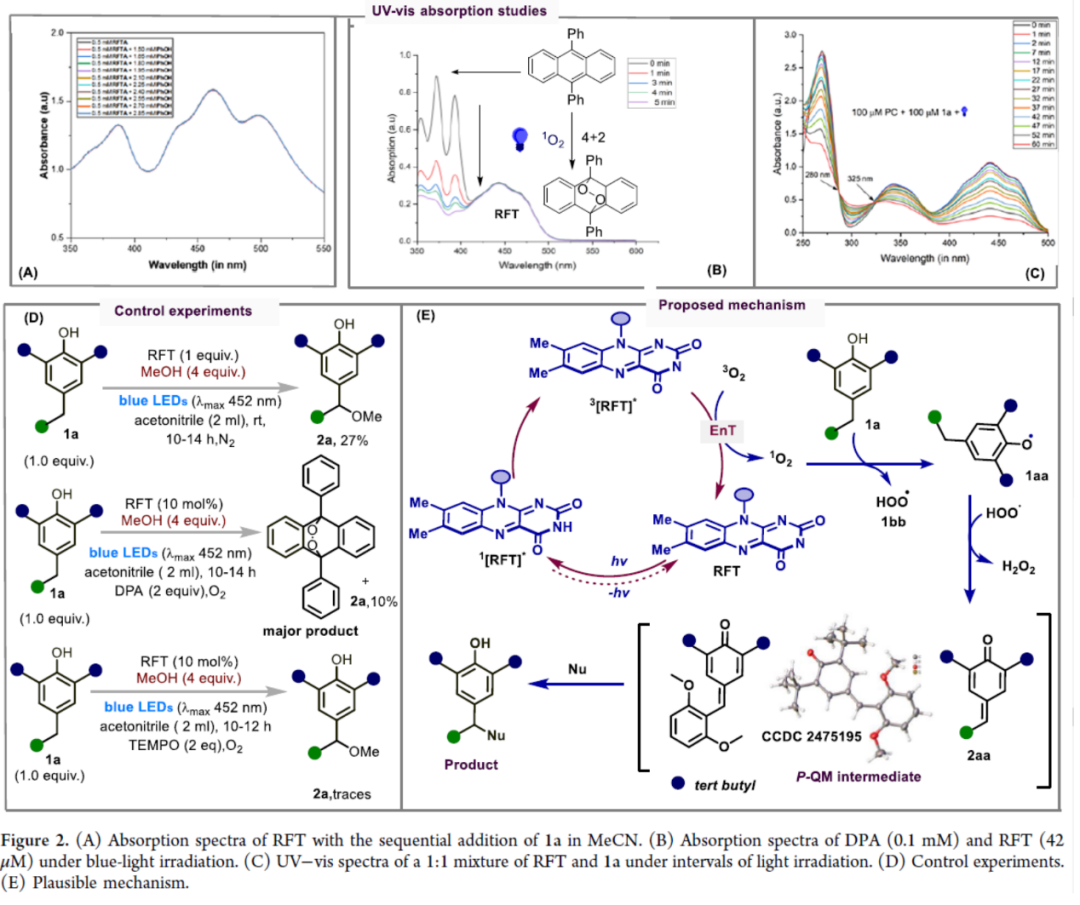
(Figure 2,图片来源:ACS Catal.)
德国雷根斯堡大学Burkhard König与印度理工学院Debayan Sarkar团队开发了一种通用的策略,可在温和、操作简便的条件下,利用普遍存在的酚类原料原位生成对亚甲基苯醌化合物(p-QMs)。该方法利用单线态氧介导的氧化机理,实现了p-QMs在室温下与多种亲核试剂(包括伯醇、仲醇、硫醇及杂环骨架)的高效苄基官能团化。值得注意的是,该策略通过一步原子经济性转化,可直接合成具有张力的螺环分子,其广泛存在于各类天然产物中。此外,通过对临床重要药物及天然产物进行后期官能团化,进一步凸显了该合成策略的实用价值。
论文信息:
Flavin-Photocatalyzed Benzylic Functionalization, Spirocyclization, and Spiroepoxidation of Phenols
Majid Ahmad Ganie, Niladri Sekhar Roy, Arslan Raza, Burkhard König, Debayan Sarkar
ACS Catal.
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




