【Org. Lett.】四川大学曹伟地/冯小明团队:实现光驱动苯并环丁烯酮与酮的不对称[4+2]环加成
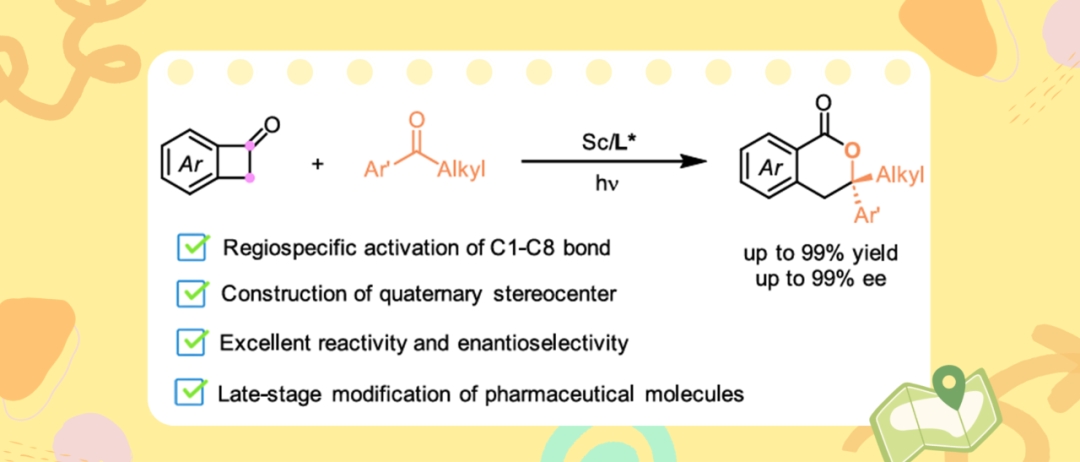
近日,四川大学曹伟地/冯小明团队在光催化不对称合成领域取得新突破。他们利用自主研发的手性双氮氧/钪催化剂(冯催化剂),实现了苯并环丁烯酮(BCBs)与芳基烷基酮的光诱导不对称[4+2]环加成反应,高效高选择性构建了含季碳立体中心的3,4-二氢异香豆素。该工作通过独特的C-C单键活化/自由基耦合机制,为药物分子后期修饰提供了新工具。相关成果发表于Organic Letters。
基于环张力化合物释放环张力过程的高反应性,化学家们设计了很多应变驱动环张力化合物的转化反应。苯并环丁烯酮(BCBs)作为有机合成中有价值的合成子,其可以通过渡金属插入的方式释放环张力,促进C1-C2或C1-C8键的断裂,形成稳定的五元金属环中间体。该中间体随后可以与π-不饱和单元结合,产生各种扩环产物(Scheme 1a)。使用光催化的方法,BCBs可以在更温和反应下实现惰性化学键的断裂和重组,且其倾向于断裂键解离能更低的C1-C8键。曹伟地/冯小明团队近几年主要聚焦光催化不对称反应开展研究,发展了手性Lewis酸辅助底物直接光激发转化策略,实现了酮、亚胺的不对称烷基化反应(J. Am. Chem. Soc. 2022, 144, 22140; Angew. Chem. Int. Ed. 2025, 64, e202500756),吲哚衍生物的不对称环加成/重排级联反应(J. Am. Chem. Soc. 2024, 146, 23457)等。在前期利用光诱导单一手性Lewis酸催化BCBs与亚胺或醛的区域专一性C1–C8键断裂/[4 + 2]环加成反应的基础上(Scheme 1b,Nat. Commun. 2024, 15, 10866; CCS Chem. 2025, 7, 573),作者设想利用上述手性Lewis酸辅助底物直接光激发转化策略,在无外加光催化剂的条件下,实现BCBs与酮的不对称[4 + 2]环加成反应,为含季碳立体中心手性3,4-二氢异香豆素的合成提供高效新方法(Scheme 1c)。
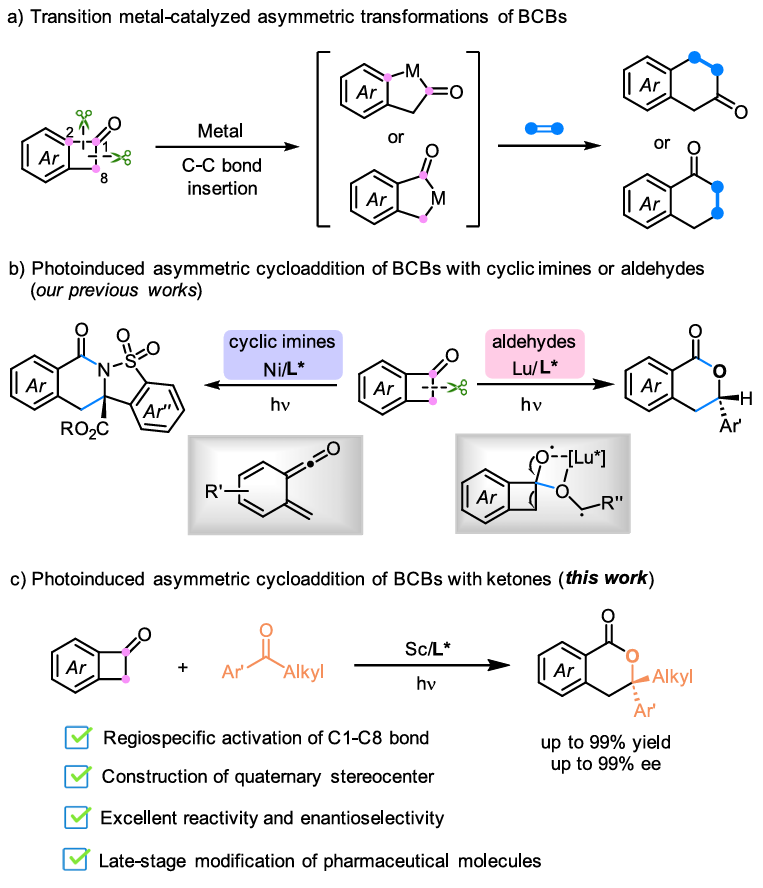
(图片来源:Org. Lett.)
条件优化:作者首先选择5-甲基苯并环丁烯酮(A1)和苯乙酮(B1)作为模板底物(表 1),使用L₃-Pr(OiPr)₂/Sc(OTf)₃配合物,二氯甲烷为溶剂,4 Å分子筛为添加剂,在-78 ℃下,365 nm光照12小时,以接近当量的产率和95% ee(编号 1)得到目标产物C1。在无Lewis酸催化剂的条件下,反应无法进行(编号 2),表明在-78 ℃时背景反应可以被完全抑制。对金属盐的筛选表明,Sc(OTf)₃在反应性中起着特别重要的作用。将反应温度提高至–10 ℃会导致副反应和背景反应(编号 6)。鉴于激发后的BCB对质子溶剂(如水)敏感,作者在反应体系中添加了4 Å分子筛作为干燥剂。但当使用无水Na₂SO4时,产率仅为13%,同时副产物增加(编号 7),这表明4 Å MS的作用不仅限于干燥作用,还能提高反应的活性。增大光照波长导致反应性降低(编号 8),增大光照强度导致背景反应增强(编号 9)。对各种手性双氮氧
配体的进一步探索表明,选择具有合适骨架、链长以及芳香酰胺基团取代基的L₃-Pr(OiPr)₂是高效高选择实现该反应的关键(编号 10-12)。
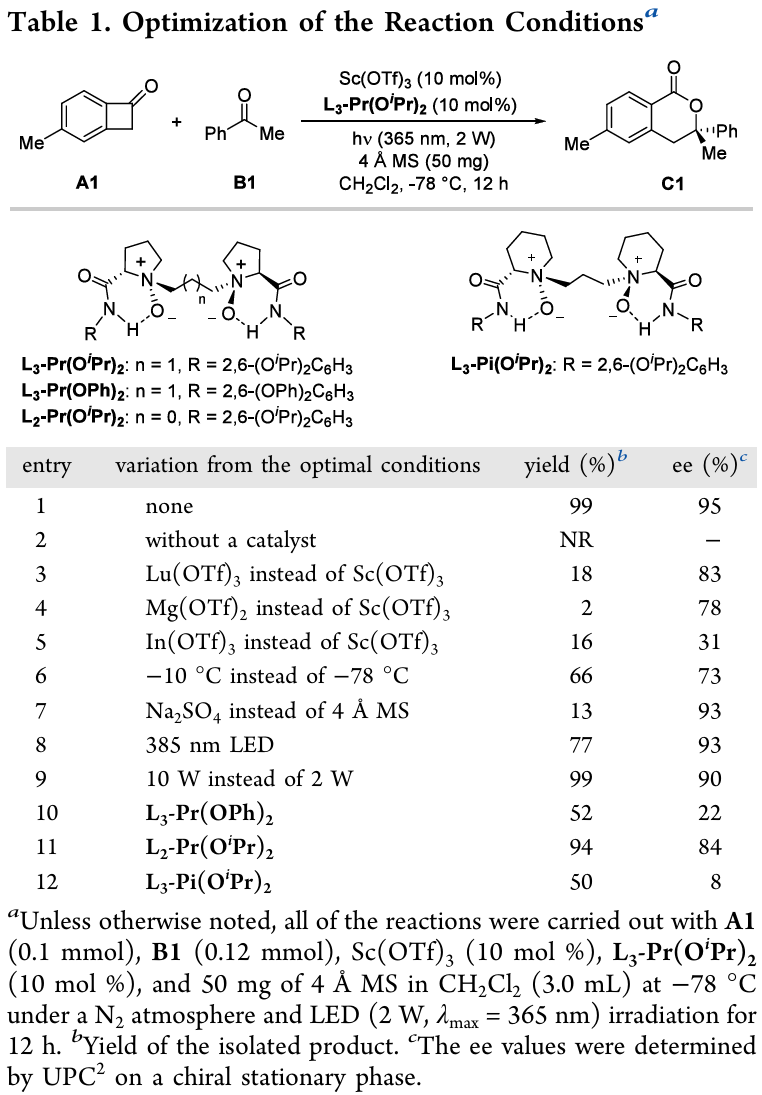
(图片来源:Org. Lett.)
底物扩展:作者考察了该反应策略对芳基烷基酮和苯并环丁烯酮的普适性(表2-3)。各种取代的苯乙酮与A1顺利进行反应,以良好至优异的对映选择性得到相应的产物(C2-C21 )。该催化体系表现出良好的官能团耐受性,可兼容多种取代基,包括腈基、三氟甲基、卤素、硅基、硼基和乙酰氧基等。杂环化合物也适用于该体系, 2-乙酰基吡啶以64%收率和85% ee转化为产物C22。将烷基取代基从甲基转换成环己基对反应性和对映选择性都有负面影响(C23,51%产率,76% ee)。氘代甲基取代的底物成功地转化为目标产物C24。此外,环酮如1-茚满酮也可以兼容该反应(C25)。值得注意的是,该策略可用于一系列药物分子后期修饰,包括去氢表雄酮、(S)-布洛芬、恩格列净中间体和维生素E等。
使用苯乙酮B1作为底物考察了BCBs的底物范围(表 3)。研究发现,BCB芳环上连接5-甲基对获得高收率和高对映体选择性至关重要。改变甲基的位置或在苯基环上引入其它取代基会不同程度地降低反应活性或对映选择性。
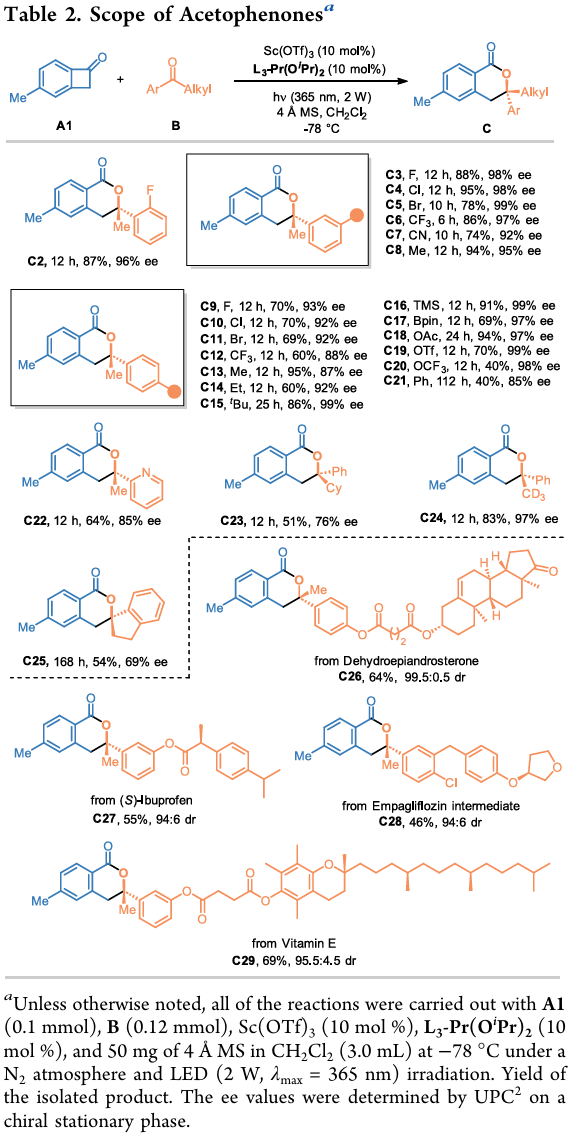
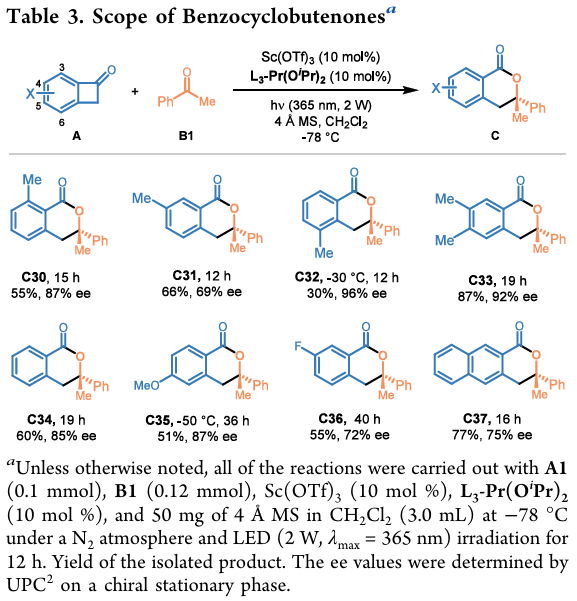
(图片来源:Org. Lett.)
产物衍生:作者对催化产物C1进行了克级规模制备以及衍生实验(Scheme 2)。将5 mmol 5-甲基苯并环丁烯酮(A1)与6 mmol 苯乙酮(B1)在同等放大的催化剂、分子筛和二氯甲烷用量下,在365 nm紫外灯照射下得到了1.15 g 目标产物(C1,91%收率),对映选择性保持(95% ee)。随后,作者首先用氢化铝锂处理C1,其内酯环上的酯羰基能够高选择性被还原为亚甲基,以当量收率和96% ee得到氧杂环产物D。当使用邻氯苯胺进行胺解时,能够以98%收率和97% ee得到相应开环酰胺产物E,其类似物具有一定的生物活性。此外,在[RuCl₂(p-cymene)]的催化下,成功实现了C1芳环上邻位羟基化反应,以54%收率,88% ee得到酚类产物F。
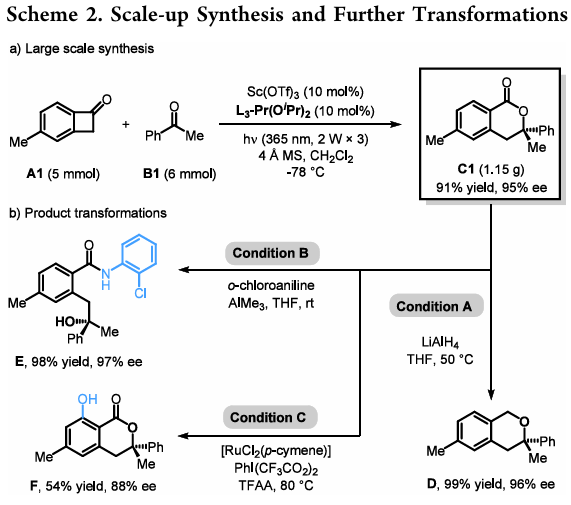
(图片来源:Org. Lett.)
机理实验:底物的紫外吸收光谱研究表明,与L₃-Pr(OiPr)₂/Sc(OTf)₃配合物配位后,在365 nm处,BCB A1或苯乙酮(B1)的紫外可见吸收光谱没有明显变化(Scheme 3a)。然而在对苯乙酮的磷光发射光谱研究中,观察到磷光发射强度增强,但最大发射波长没有明显移位(Scheme 3b)。这些结果表明,Lewis酸催化剂可能提高了系间窜越(ISC)的效率,使得激发三线态苯乙酮的比例增加,从而有利于反应进行。加入BHT作为自由基捕获剂,A1和B1的环加成反应被抑制,同时高分辨率质谱(HRMS)检测到交叉偶联副产物G和H,表明体系中含有双自由基G1和H1(Scheme 3c)。对照实验表明,由A30原位生成的邻甲亚基联烯酮中间体经高温或在光照或不光照下使用Aa1均不能得到目标产物C33,排除了经过邻甲亚基联烯酮中间体的反应历程(Scheme 3d)。
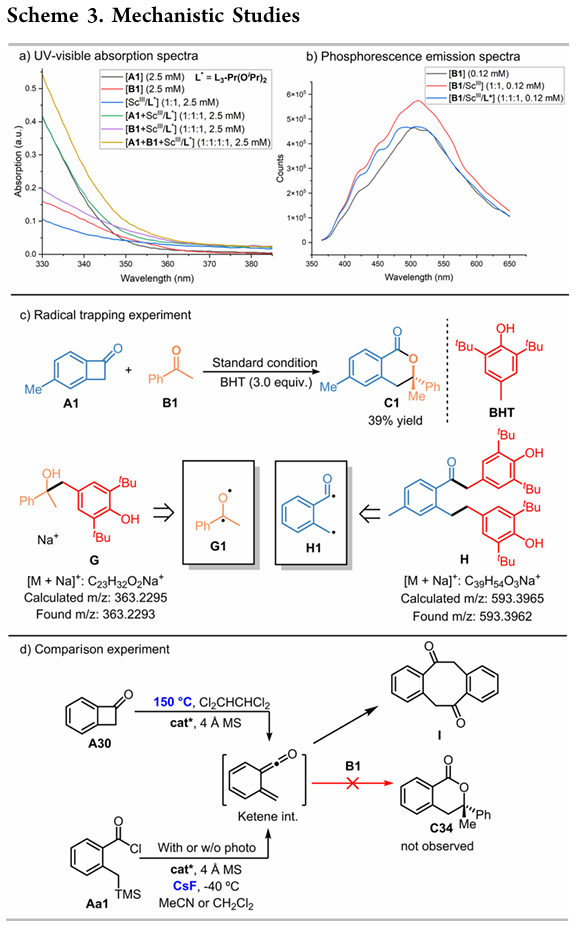
(图片来源:Org. Lett.)
基于以上机理研究,作者提出了可能的光环加成反应历程(Scheme 4)。首先,金属盐Sc(OTf)₃与手性双氮氧配体L₃-Pr(OiPr)₂配位,原位生成手性钪(III)配合物催化剂。该Lewis酸催化剂同时与苯并环丁烯酮A1和苯乙酮B1配位,其中B1在光照条件下被激发到达激发态,紧接着其氧自由基对苯并环丁烯酮A1的羰基进行自由基加成,诱导C1-C8键均裂以释放环张力,形成双自由基中间体,最后发生快速地分子内自由基-自由基偶联,完成该光环加成反应,并释放催化剂。此外,A1光异构化产生的邻甲亚基联烯酮中间体存在于该体系,但不是生成目标产物的中间体。
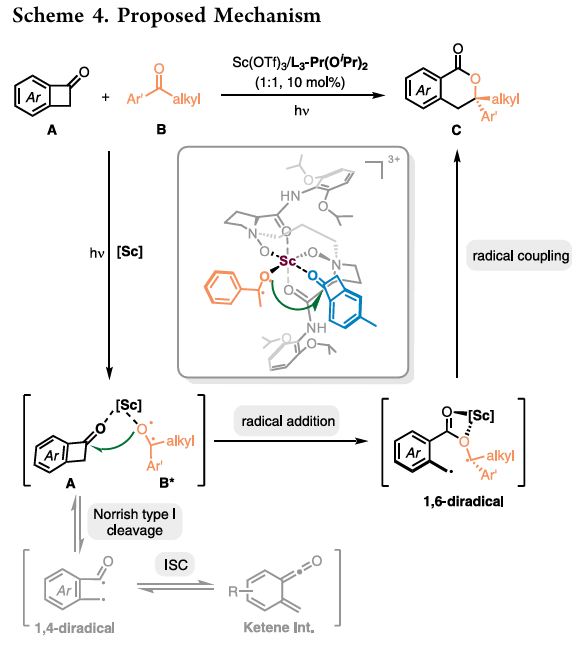
(图片来源:Org. Lett.)
该研究发展了一种光催化苯并环丁烯酮和芳基烷基酮的不对称[4 + 2]环加成反应,在温和条件下高效高选择性合成一系列含有季碳立体中心的光学活性3,4-二氢异香豆素类化合物。该方案适合于天然产物类似物的合成、克级合成和各种衍生化。该反应将为C-C活化转化提供了高效新方法。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




