【Org. Lett.】新疆大学刘晨江/张永红课题组:可见光介导N-芳基/苯甲酰基丙烯酰胺与CO₂的串联芳基羧基化/环化反应
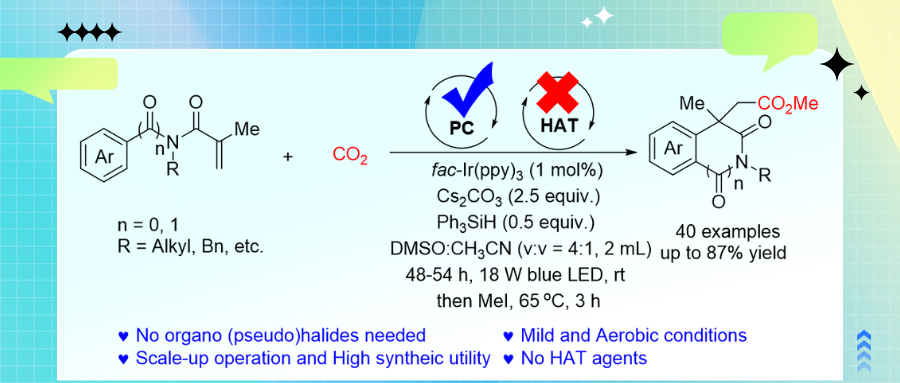
异喹啉二酮和氧化吲哚是多种天然产物和药物的核心骨架,其中1,3-二氧基-1,2,3,4-四氢异喹啉-4-基乙酸和2-氧代吲哚啉-3-乙酸是合成具有生物活性的三环生物碱的关键中间体。因此,开发通过廉价易得原料合成此类化合物及其衍生物的绿色实用方法具有重要意义。尽管通过金属催化和可见光催化N-芳基丙烯酰胺羧化制备2-氧代吲哚啉-3-乙酸衍生物取得了进展。然而,苛刻的反应条件极大的限制了它们的应用。作为有机合成领域的研究热点,通过可见光催化CO2单电子转移(SET)还原生成高活性CO2•−与烯烃和芳烃等的直接羧化成为合成高附加羧酸衍生物的高效经济方法。因此,开发以储量丰富、廉价无毒的CO2为羧基源合成上述杂环羧酸的高效绿色方法对于温室气体的高值资源化和精细化学的绿色合成意义重大。
近日,新疆大学刘晨江教授、张永红教授团队在绿色有机光/电合成的前期工作基础上(Green. Chem. 2025, 27, 7114; Org. Chem. Front. 2025, 12, 3256; Org. Lett. 2024, 26, 4329; Org. Chem. Front. 2024, 11, 1050),特别是在光催化自由基串联环化的研究基础上(Green Synth. Catal. 2024, 5, 319; Org. Lett. 2024, 26, 10259; J. Org. Chem. 2024, 89, 5783),发展了在绿色温和条件下可见光介导N-芳基/苯甲酰基丙烯酰胺与CO2的串联芳基羧基化/环化反应,合成了一系列酯基取代的异喹啉-1,3(2H,4H)二酮和氧化吲哚衍生物(图1)。
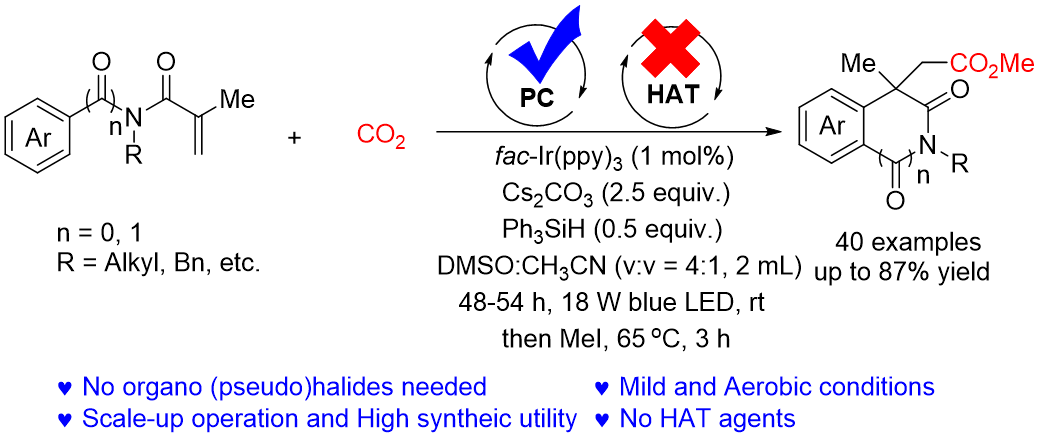
图1 可见光介导N-芳基/苯甲酰基丙烯酰胺与CO2的串联芳基羧基化/环化反应(来源:Org. Lett.)
条件筛选中,作者通过控制变量分别对反应中碱的种类和量、溶剂、光催化剂、反应时间进行了系统的考察后,确定了最优反应条件为:N-甲基-N-甲基丙烯酰基苯甲酰胺(0.2 mmol),CO2(1 atm),fac-IrIII(ppy)3作为光催化剂,Cs2CO3作为碱,Ph3SiH为添加剂,2 mL的DMSO/乙腈作为混合溶剂,在18 W蓝光下室温反应48小时,以67%的收率得到相应的目标产物。在此条件下,作者首先对N-烷基-N-甲基丙烯酰基苯甲酰胺底物的芳基范围进行了考察(图式1),给电子取代基和吸电子取代基都能以中等的收率得到相应的产物。底物苯基间位或邻位甲基和溴取代时也有良好的反应性。此外,二甲氧基取代的底物也可以顺利的生成目标化合物。随后,作者考察了N-保护基的底物范围。令人满意的是,具有各种直链和支链的底物都能顺利的得到相应的产物。最后,对杂芳烃环也进行了探索,遗憾的是未检测到目标产物。
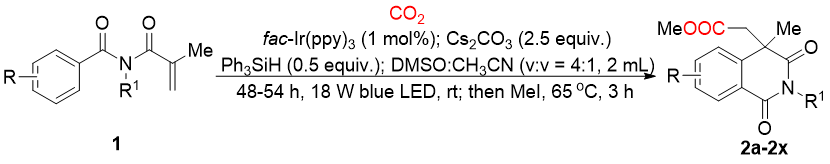
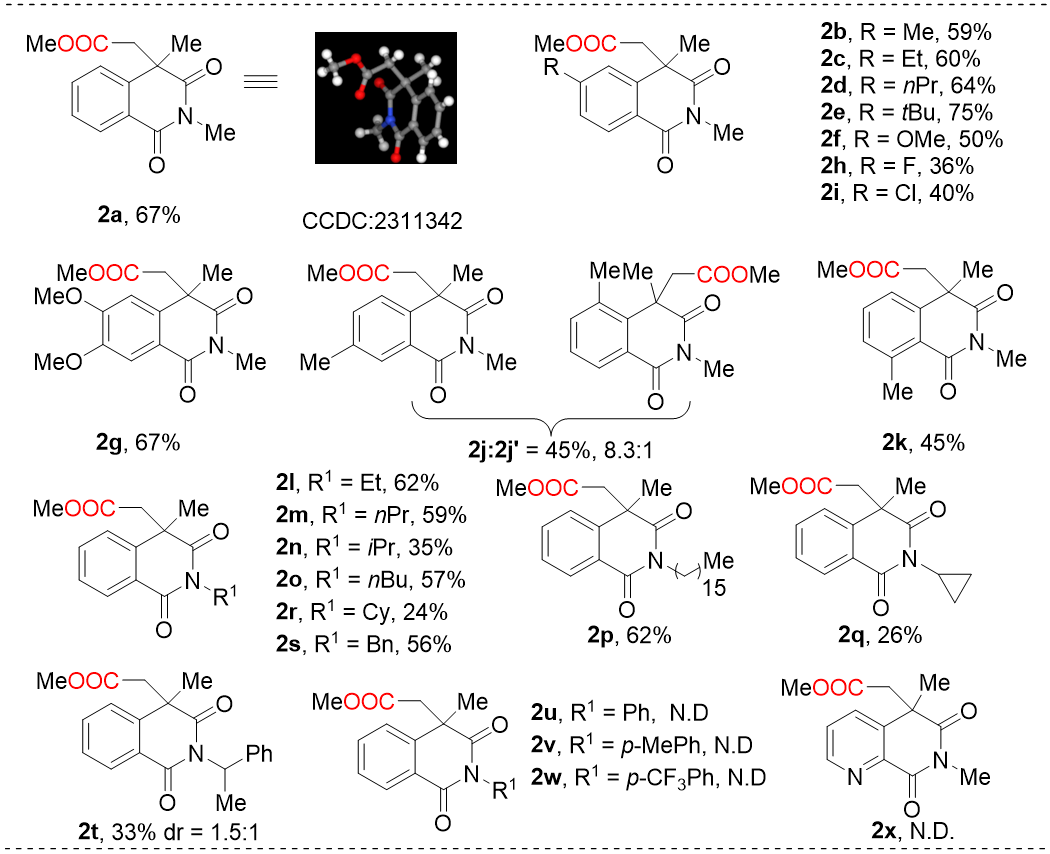
图式1 N-烷基-N-甲基丙烯酰基苯甲酰胺与CO2的底物范围(来源:Org. Lett.)
为了进一步证明该方案底物的普遍性,研究了N-烷基-N-苯基丙烯酰胺底物合成2-氧代吲哚啉-3-乙酸酯的底物范围(图式2)。首先对单取代芳环进行了考察,以中等收率获得了目标产物。此外,该方法对于二甲基取代底物也具有较好的耐受性。不同的N保护基的丙烯酰胺底物也能顺利的合成目标产物。然而,N-甲基-N-苯丙烯酰胺底物却未检测到相应的产物。

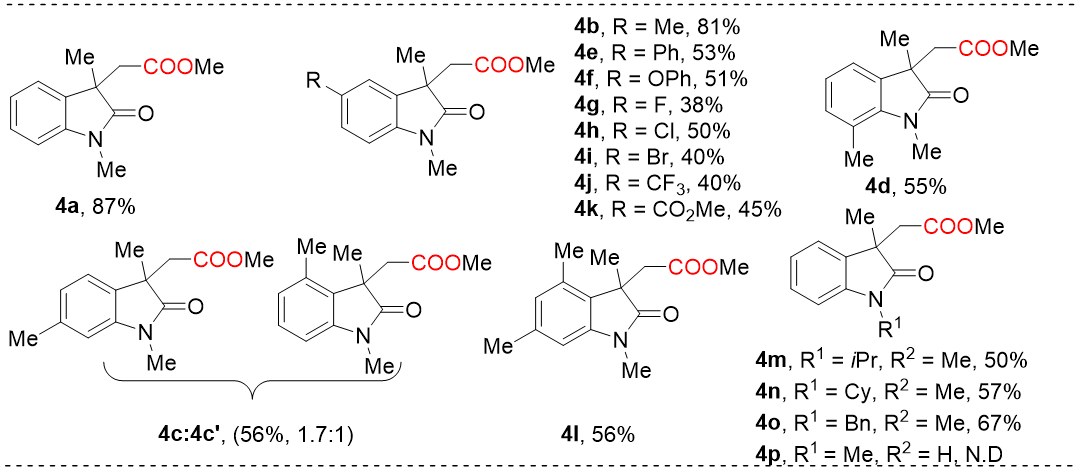
图式2 N-烷基-N-苯基丙烯酰胺与CO2的底物范围(来源:Org. Lett.)
为了进一步考察该方法的潜在应用性,作者开展了扩大规模实验(图式3),在改进的反应条件下,在反应规模扩大近18倍的条件下仍能以32%的产率获得目标产物2g。此外,在克级规模下也能以72%的产率合成产物5a。此外,作者还通过2a和5a的衍生化实验来更进一步证明该方法潜在的合成应用前景。首先,产物2a与甲胺通过胺酯交换高效得到了酰胺6a。其次,产物5a与甘氨酸乙酯盐酸盐缩合以92%的产率得到了酰胺7a。最后,BH3·SMe2还原5a可以产生吲哚啉衍生物8a,该产物是合成MNKS抑制剂的关键中间体。
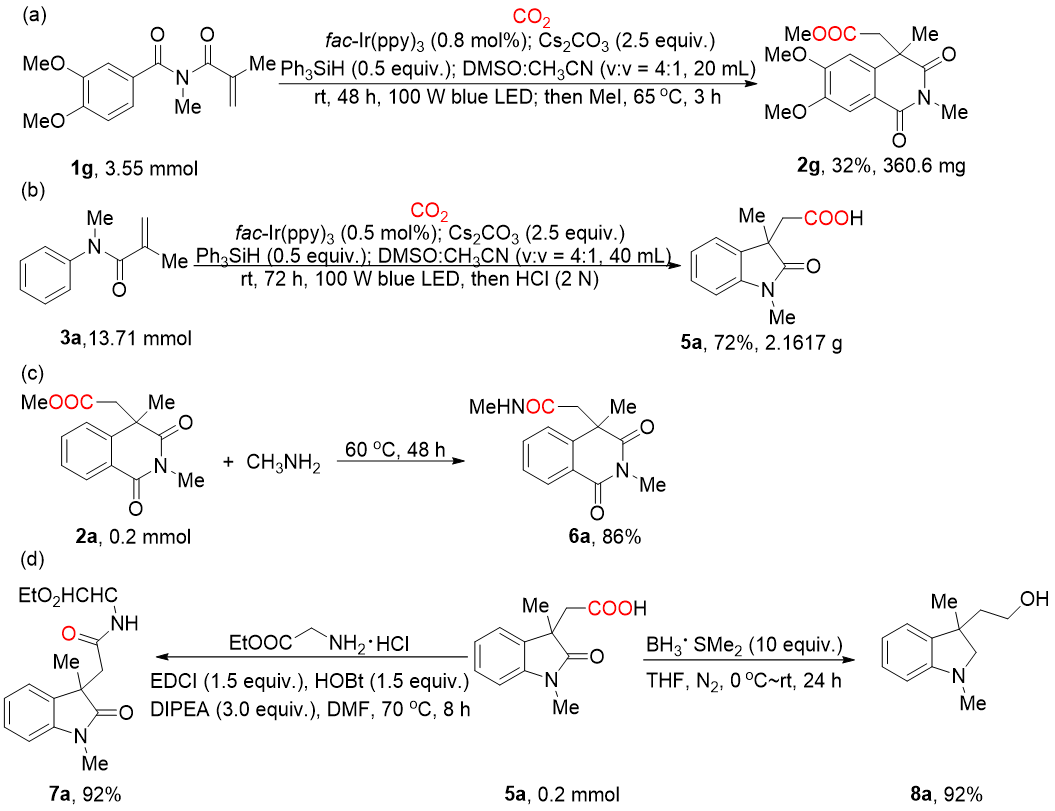
图式3 放大反应和产物衍生化实验(来源:Org. Lett.)
为阐释反应机理,作者进行了自由基捕获实验,在反应体系中加入包括TEMPO或PhSeSePh在内的自由基捕获剂后,产物2a的生成被完全抑制,这证实了反应涉及自由基历程。值得一提的是,通过高分辨质谱检测到了CO2•−与烯烃自由基加成生成的关键中间体自由基与TEMPO加合物。接着,在氮气气氛下,未检测到还原产物1a′,而以65%的产率生成副产物9a。这表明活化烯烃1a在反应中没有被还原,而导致其光诱导分解。最后,在有或无1a存在的条件下进行甲酸盐(HCO₂⁻)检测实验,结果表明均能检测到甲酸盐,甲酸盐可转化为关键中间体CO₂•⁻(图式4)。
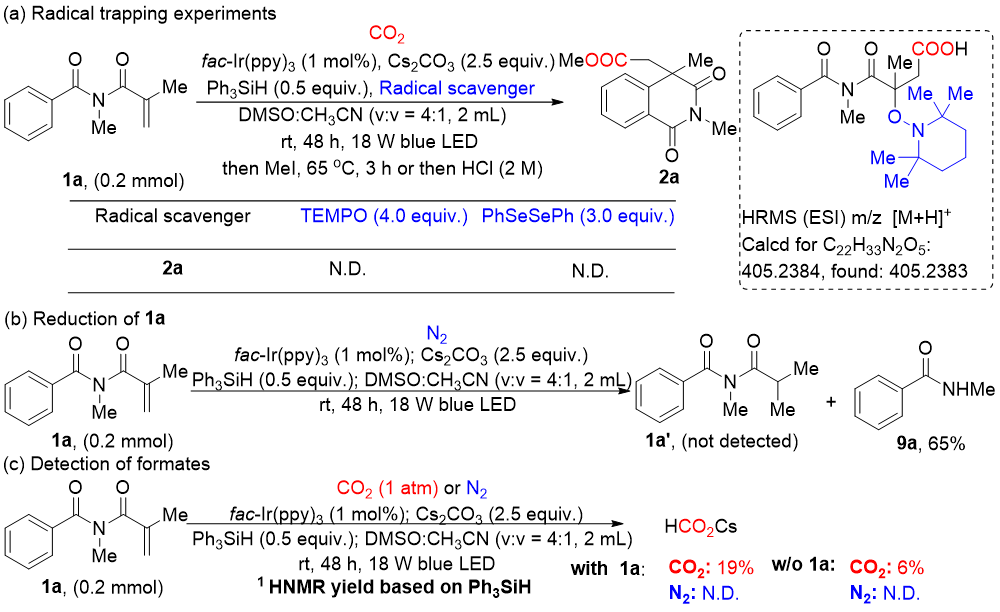
图式4 机理验证实验(来源:Org. Lett.)
作者根据上述实验结果提出了如下反应机理(图式5):首先,可见光激发fac-IrIII(ppy)3得到fac-IrIIII(ppy)*。随后,激发态光敏剂将1a通过氧化还原生成fac-IrII(ppy)3和1a阳离子自由基。然后,fac-IrII(ppy)3(E1/2 III/II=−2.19 V vs SCE)通过SET还原CO2[E1/2(CO2/CO2•−)=−2.21 V vs SCE]生成CO2•−。随后,1a的C=C键与CO2•−发生自由基加成反应,形成碳自由基中间体A。中间体A通过分子内环化反应产生自由基中间体B。之后,中间体B和HCO2-被1a自由基阳离子或fac-IrIII(ppy)3*氧化得到C、CO2•-和fac-IrII(ppy)3,然后脱质子化得到D。最后,D被MeI酯化得到2a。
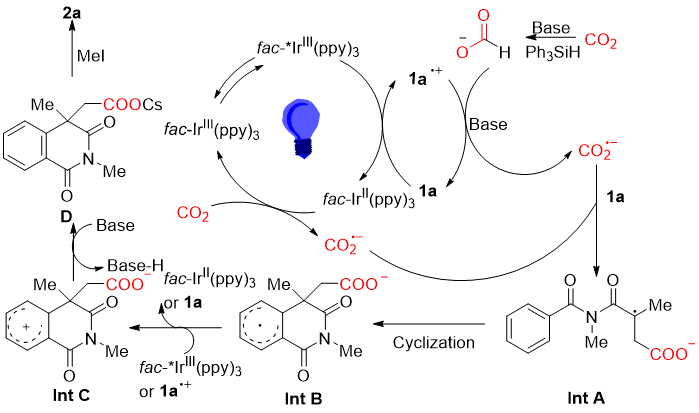
图式5 可能的机理(来源:Org. Lett.)
在国家自然科学基金、新疆维吾尔自治区自然科学基金和新疆维吾尔自治区英才计划等项目的资助下,新疆大学刘晨江教授、张永红教授团队发展了通过可见光催化CO2通过单电子转移(SET)产生CO2自由基阴离子的策略实现了可见光介导N-芳基/苯甲酰基丙烯酰胺的串联芳基羧基化/环化反应,合成了一系列酯基取代的异喹啉-1,3(2H ,4H)二酮和氧化吲哚衍生物。该反应具有广泛的底物范围、简单的操作、优异的官能团兼容性、反应条件温和、可实现克级合成和产物易于衍生化等优点。机理表明,在无额外HAT和还原剂的条件下,原位产生的CO2•−作为关键的活性中间体参与该反应中。
论文信息:
Visible-Light-Mediated Cascade Arylcarboxylation/Cyclization of N‑Aryl/Benzoyl Acrylamide with CO2
Tao Zhang, Ziren Chen, Fei Xue, Xinxin Ren, Bin Wang, Weiwei Jin, Yu Xia, Shaofeng Wu, Azhar Iqbal, Yonghong Zhang, and Chenjiang Liu
Org. Lett. 2025, Accepted Manuscript
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




