UCSB杨扬、PITT刘鹏 Science: 一种光生物催化的立体选择性的三组分自由基偶联反应

由哈佛大学Schreiber教授首先提出的多样性导向合成(diversity-oriented synthesis, DOS)在药物研发中具备重要的应用。通过构建兼具骨架、官能团和立体化学多样性的化合物库,DOS可以解决化学和生物学中的困难问题。在众多DOS方法中,多组分反应因能在一步中快速构建复杂结构而备受青睐。
酶在立体选择性控制方面具有独特优势,但除非是如非核糖体肽合酶(non-ribosomal peptide synthetases, NRPSs)和聚酮合酶(polyketide synthases, PKSs)这样的流水线合成酶系统,单独结构域的酶在多样性合成中的应用仍很有限,主要受制于其有限的底物范围。近年来,光生物催化通过结合可见光氧化还原催化与酶催化,使多种天然酶能够催化自然界中不存在的有合成价值的转化反应。其中,磷酸吡哆醛(PLP)依赖的酶因其独特的羰基催化机制,能够生成多种用于碳–碳键形成的共价反应中间体,具备很大潜力。
2023年以来,杨扬教授课题组通过生物催化与光催化的协同作用,首先提出并且实现了吡哆醛(PLP)酶的功能重构,将多种闭壳层机制的吡哆醛酶改造成自由基酶,实现了多类分子间不对称自由基偶联反应(参见课题组前期工作: Science 2023, 381, 444; Nature 2024, 629, 98)。然而,实现适合于DOS的酶催化多组分反应仍面临很大挑战。自由基中间体的不稳定性以及光催化剂与酶之间复杂的自由基转移过程,使得在多组分生物催化反应中实现高效自由基传递变得尤为困难。
为应对上述挑战,对脱羧型磷酸吡哆醛依赖酶进行重新功能化和定向进化,利用优势突变体和光氧化还原催化剂协同催化的机理,实现了一系列全新的、立体选择性的三组分自由基碳-碳偶联反应(图1)。在提出的光氧化还原循环中,有机硼底物1在光催化剂Rose Bengal的激发态作用下发生单电子氧化,生成活性自由基中间体I。该自由基与α,β-不饱和底物加成,生成一个新的亲电性自由基中间体radical-II。与此同时,在生物催化循环中,脱羧型磷酸吡哆醛依赖酶(如天冬氨酸β-脱羧酶)与β-羧基氨基酸底物3发生转亚氨基反应生成外部醛亚胺a,随后经α位去质子化形成醌式中间体III。该中间体进一步经1,3-质子迁移及β-脱羧作用,转化为与PLP结合的亲核性中间体IV。若由光催化生成的自由基中间体radical-II能够进入酶的活性位点并与烯胺中间体IV反应,则该自由基加成将受到酶的立体选择性调控,形成多个手性中心的中间体α-radical VI,其可进一步被光催化剂氧化为亚胺酮中间体VII。接下来的酶促1,3-质子迁移与亚胺交换将释放三组分偶联产物,并完成整个催化循环。此外,当自由基加成至α,β-不饱和底物2生成β位手性自由基时,酶促平行动力学拆分(PKR)可将β位手性匹配的自由基II转化为含有多个连续手性中心的三组分偶联产物。与此同时,构型不匹配的自由基radial-II则通过电子转移/质子转移(ET/PT)机制发生氢烷基化反应,生成具有对映体富集的产物9。
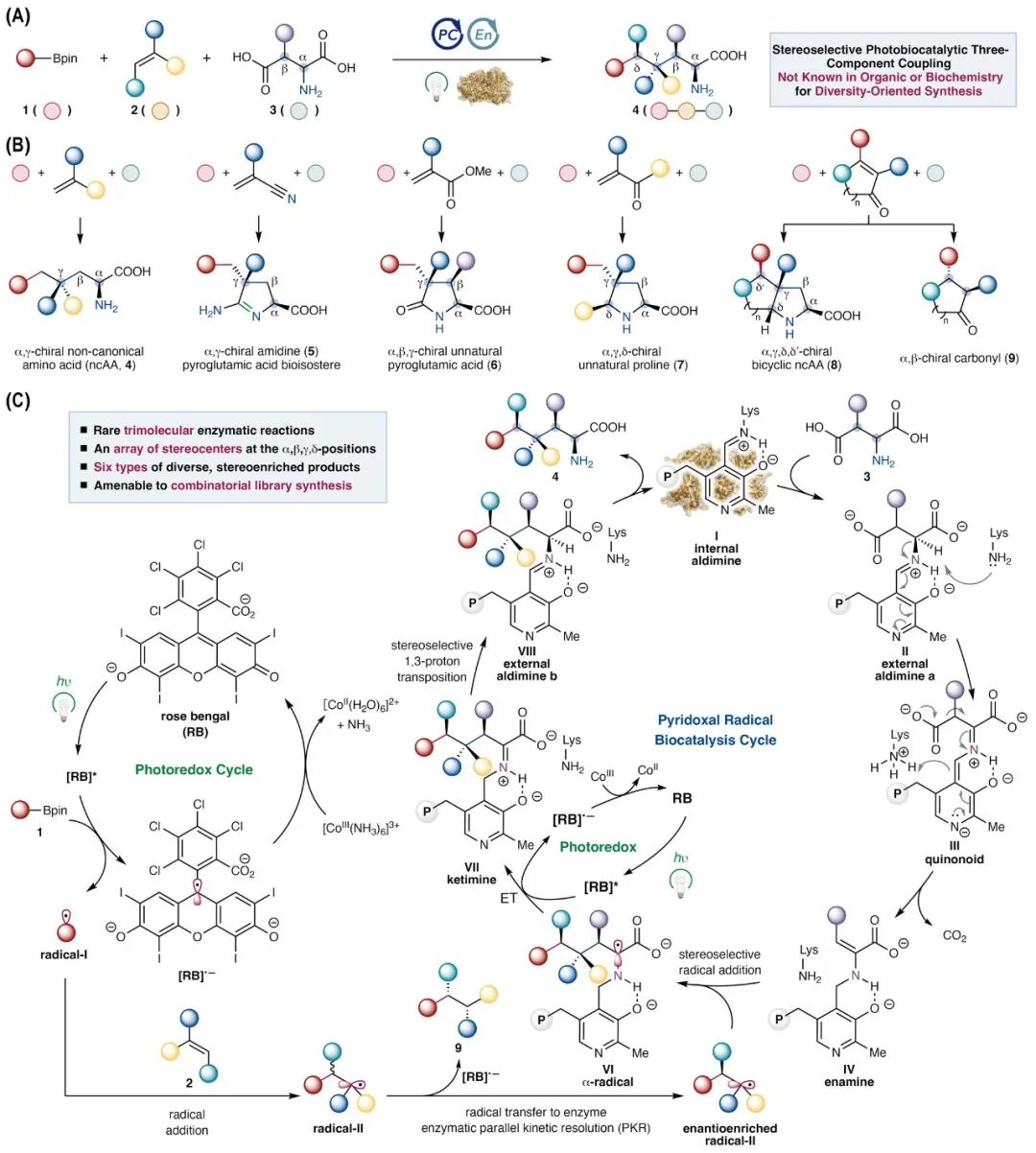
图1. 光酶协同催化的多组分自由基偶联
首先,选用苄基硼酸频哪醇酯(1a)、甲基丙烯腈(2a)和天冬氨酸(3a)作为生物催化三组分自由基偶联反应的模型底物(图2A)。使用0.5 mol% UstD L392G酶、3 mol% Rose Bengal(RB)光催化剂,在520 nm光照、200 mol% Co(NH3)6Cl3和10 mol% PLP的条件下,以9%的产率、74:26的d.r.值和大于99:1的e.r.值成功获得了目标三组分偶联产物5a。该产物5a为环状脒结构,来源于非天然氨基酸中间体4a中α-氨基对腈基发生的自发性5-exo-dig环化加成。当反应体系中缺少PLP依赖脱羧酶UstD L392G或光催化剂RB时,4a或5a均未生成。在不加入Co(NH3)6Cl3的条件下亦未获得5a。将照射波长改为440 nm后,5a的产率下降至4%,但d.r.和e.r.保持不变。进一步对几种可吸收520 nm的光催化剂进行了评估,发现RhB和Eosin Y所得产率显著低于RB。基于上述初步结果,借助实验室构建的高通量光生物催化平台,进一步对脱羧型PLP酶进行定向进化(图2B)。在起始阶段,通过筛选已有的UstD酶变体库,发现UstD2.0表现出最高的初始活性(产率23%,d.r. = 88:12,e.r. >99:1)。以PLP辅酶因子附近柔性肽链上的391–393位残基为靶点,采用位点饱和突变(SSM)筛选,每轮定向进化通过UPLC-MS对88个突变体进行高通量分析。通过柔性肽链区域的结构优化,在三轮进化后获得三突变体UstD2.0 T391A M393W L392Q(UstDAWQ),其可使反应收率显著提升,但非对映选择性却明显降低(产率78%,d.r. = 83:17)。随后,作者通过对靠近392位的60位残基进行突变,发现S60G突变可进一步提升产物5a的非对映选择性,但是产率略有下降。考虑到60位和392位之间可能存在相互作用,在最终一轮进化中构建了Q392X G60X的双位点饱和突变库,最终筛选获得UstD2.0 T391A M393W L392M S60M(UstDAWMM),其在催化活性和非对映选择性方面均优于第四代变体UstDAWQG。在使用0.5 mol% UstDAWMM和3 mol% RB的条件下,作者以77%的产率,98:2的d.r.值和大于99:1的e.r.值获得产物5a。将UstDAWMM的用量降低至0.1 mol%,仍可获得51%的产率,总转换数(TTN)为510。此外,UstDAWMM还能利用动力学拆分机制催化消旋天冬氨酸 (rac)-3a形成5a,且产率、立体选择性与对映体选择性无显著变化。
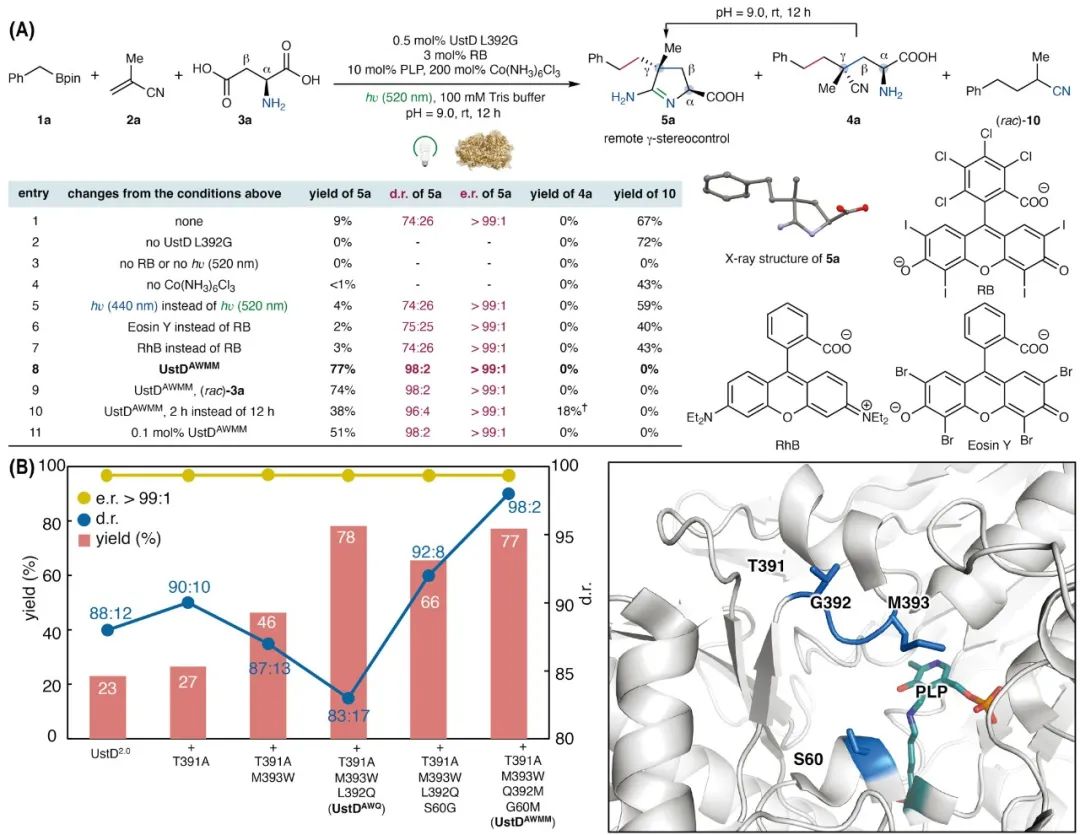
图2. 反应条件优化和酶的定向进化
随后在最优条件下对该反应的底物范围进行了探索(图3)。结果显示,不同官能团取代的苄基自由基都能很好的兼容该转化。例如:对位(5b)、间位(5c)、邻位(5d)甲基取代、多种供/吸电子基团(5e-5l)以及杂环(5m-5o)都能表现出良好的反应兼容性。值得一提的是,除了苄基自由基外,烯丙基自由基(5p)、α-杂原子碳自由基(5q)、甚至寿命极短的非稳定的一级烷基自由基(5r)或二级烷基自由基环戊基(5s)和异丙基(5t)等,也能得到可观的产率和出色的立体选择性,进一步展示了该三组分自由基偶联反应的底物广泛性。
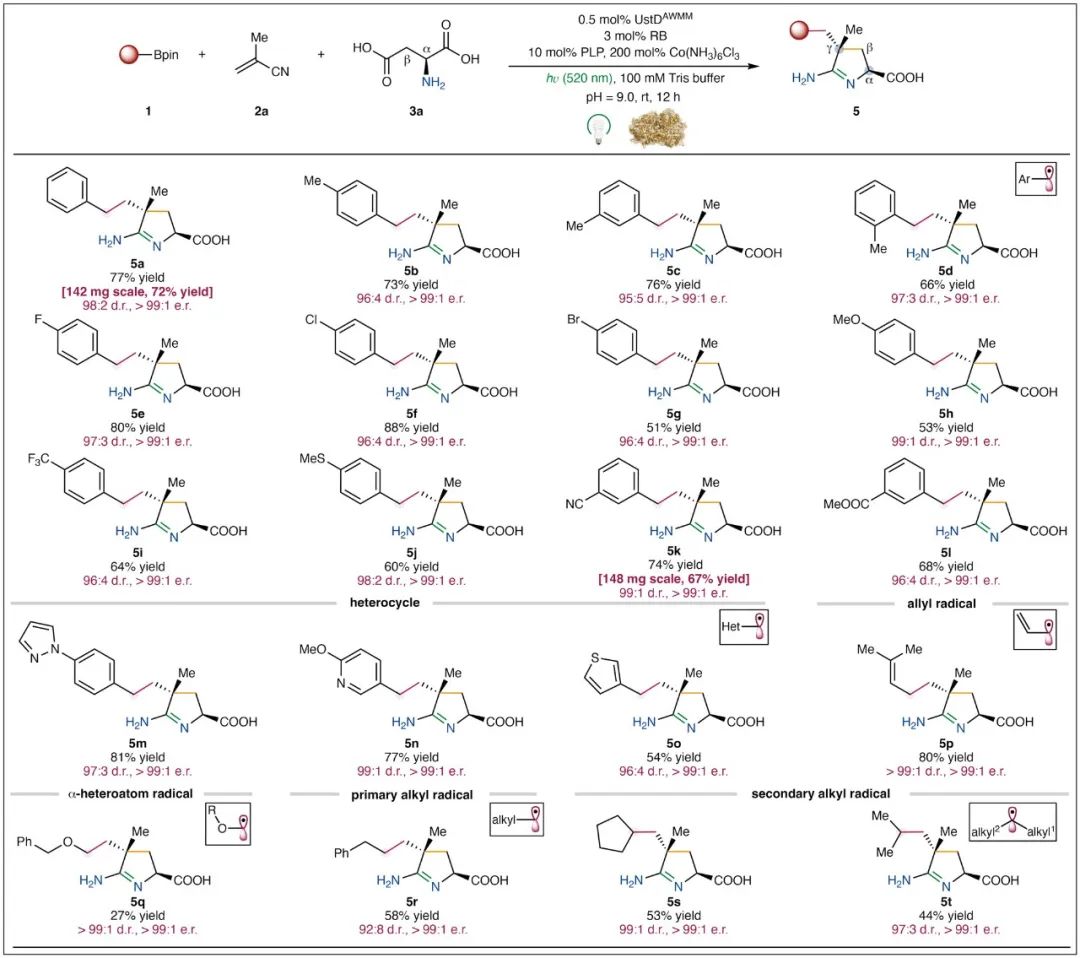
图3. 底物拓展
进一步评估了其他种类的 α,β-不饱和底物在该三组分自由基偶联反应中的适用性(图4A)。首先,使用丙烯腈(2b)和酶工程中筛选出的突变体UstDAWLG,可成功获得未环化的产物4b,其中含有间隔的α,γ-手性中心。其次,使用丙烯酸甲酯(2c)与突变体UstDAWAS,通过调控反应pH,可实现产物选择性控制:在pH = 8、KPi缓冲体系中,主要生成链状产物4c;而在pH = 9、Tris缓冲体系中,由于碱性增强促进了胺的转酰化反应,最终选择性生成环化产物焦谷氨酸类似物6a。该三组分偶联策略同样适用于α-取代丙烯酸酯(2d和2e)。例如,使用甲基甲基丙烯酸酯(2d)与UstDAWLS酶催化,可得到具有γ-四取代手性中心的焦谷氨酸类似物6b。当使用α-亚甲基-γ-内酯(2e)作为底物时,可以获得带有游离羟基的焦谷氨酸类似物6c。此外,α,β-不饱和醛和酮也是良好的底物,它们能生成δ-氧代-α-氨基酸中间体,并进一步自发进行胺-羰基的分子内缩合反应,形成相应的环状亚胺(11,图4B)。借助早期在酶库中筛选获得的亚胺还原酶IRED-110,这些环状亚胺可高效转化为多取代的脯氨酸类似物,表现出优异的非对映与对映选择性。例如,UstDAWMM可催化甲基丙烯醛(2f)顺利生成环状亚胺中间体,经IRED还原后得到γ,γ-二取代脯氨酸类似物7a;UstDAWQ亦可将甲基异丙烯酮(2g)转化为环状亚胺,随后经IRED催化还原,高立体选择性的生成2,5-syn-γ,γ,δ-三取代脯氨酸类似物7b。综上,该光生物催化三组分自由基偶联反应在自由基受体的适用范围和生成产物的结构多样性方面均展现出巨大潜力,为多样性导向合成(diversity-oriented synthesis)提供了有力工具。
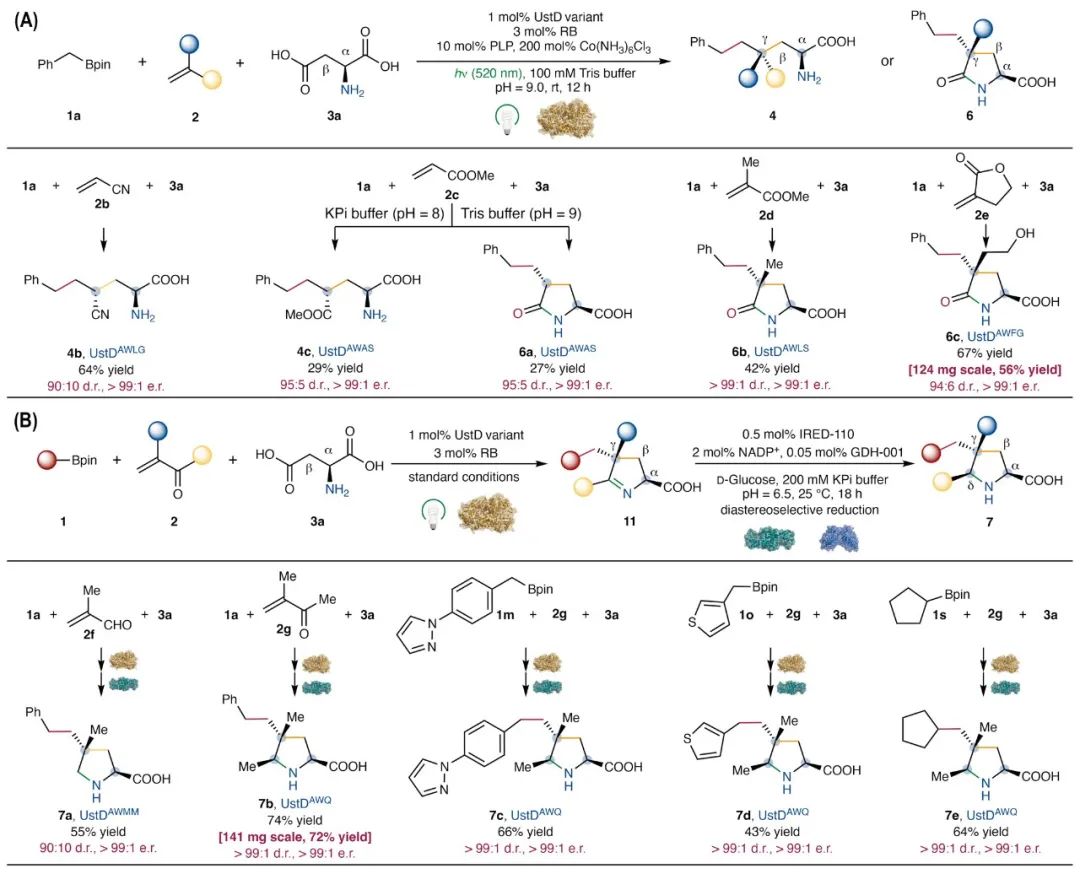
图4. 不同α,β-不饱和底物拓展合成不同种类的非天然氨基酸
为了进一步展示酶对具有挑战性的三组分自由基偶联反应的立体选择性调控能力,通过展示了三种额外的立体诱导机制,对该光生物催化平台进行了拓展(图5)。首先,对于带有较大α-取代基的丙烯腈(2h),实验发现可以在酶的调控下,选择性生成不同的非对映体产物,且具备出色的立体选择性(图5A)。例如,使用UstDAWQ可获得(2S,4S)-5u,而换用UstDAWYN则可合成非对映体(2S,4R)-5u。这一结果代表了光生物催化领域中酶控制的非对映选择性立体发散自由基C–C键形成的罕见实例。其次,使用经过工程化的PLP酶UstDAWLG,非天然氨基酸底物β-甲基天冬氨酸(β-Me-Asp,3b)也能高效转化为具有明确定义手性结构的产物6d,产物中包含连续的α、β、γ-手性中心,且γ位为季碳(图5B)。该反应通过酶促动力学拆分机制实现,起始底物为商业可得的DL-β-Me-Asp(包含四种非对映体)。反应最终通过转酰化形成内酰胺产物6d。进一步研究表明,仅(2S,3S)-3b可被UstDAWLG识别并转化,其余三个非对映体(包括(2S,3R)-、(2R,3S)-和(2R,3R)-3b)无法反应,进一步验证了该动力学拆分机制。最后,发现该三组分光生物催化偶联反应还可实现酶促平行动力学拆分,从而同时生成两个具备多个手性中心的高对映纯产物(图5C)。当β-取代的α,β-不饱和酮作为自由基受体时,首先发生非酶促C–C键形成反应,生成一个具有β-碳手性的α-碳自由基。之后,若该自由基手性与酶匹配,即可进入酶的活性位点,与酶形成的烯胺中间体反应,生成三组分偶联产物12。而当该自由基手性与酶不匹配时,则会被光敏剂的自由基阴离子(RB•-)直接还原,通过电子转移/质子转移(ET/PT)机制生成共轭加成产物9。例如,使用2-甲基-2-环戊烯酮(2i)为底物时,反应可同时生成两个高对映纯产物:一个是含四个手性中心的桥环结构产物8a,另一个是α,β-二取代的环戊酮9a。同样,使用2-甲基-2-环己烯酮(2j)时,生成的两个产物分别为含四个手性中心的氨基酸衍生物8b和双取代环戊酮9b。通过这一策略制备的非天然双环氨基酸在药物化学和不对称有机催化中具有重要应用价值。目前,对于无法进行双点配位的α,β-不饱和羰基化合物,实现对映选择性的Giese型自由基加成仍是一项挑战,该光生物催化平行动力学拆分系统的进一步发展,或可为此类难题提供新的解决思路。
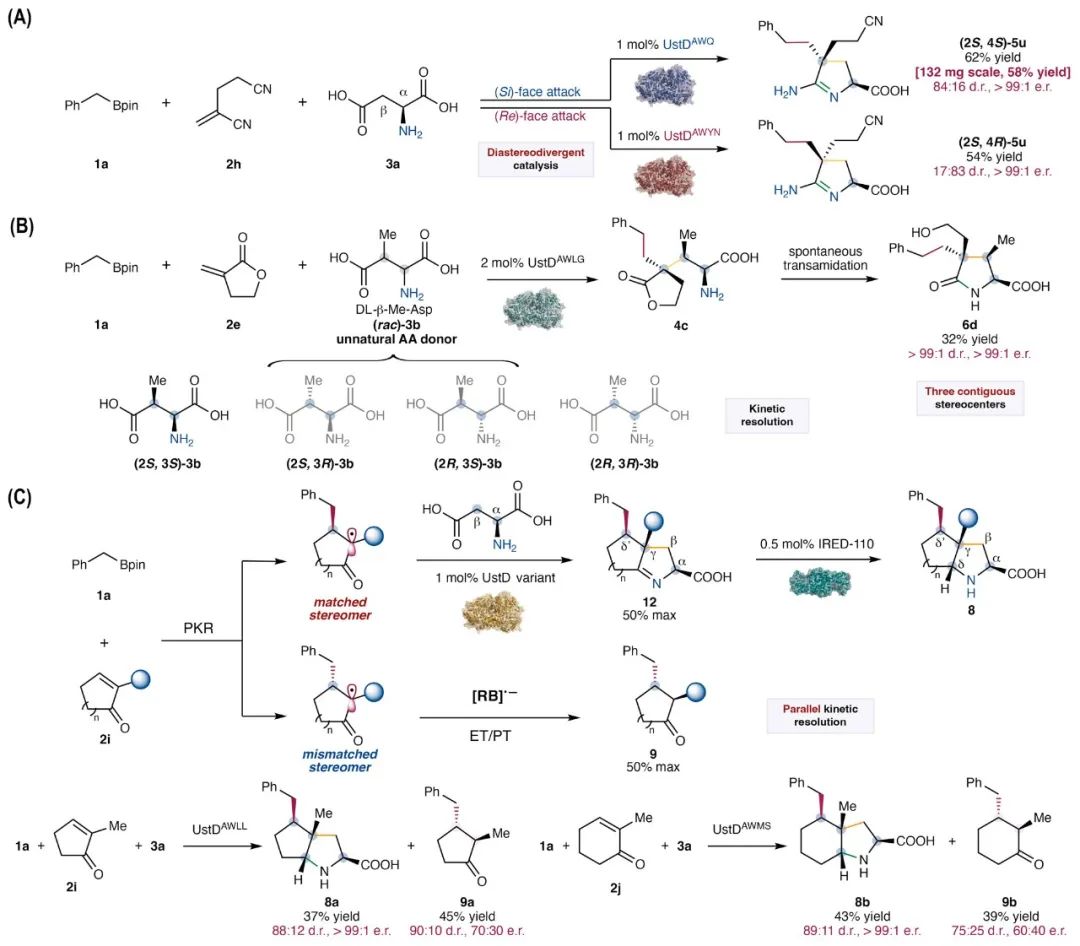
图5. 酶催化的三组分自由基偶联反应的立体选择性调控能力
由于该三组分自由基偶联反应所展现出来的罕见的广泛底物适应性和产物结构的多样性,进一步探讨是否可以利用这一平台开展分子多样性导向的组合化学式的酶法合成(diversity-oriented combinatorial enzymatic synthesis),以高效构建化合物库(图6)。为此,挑选了十种结构多样的自由基前体和十种自由基受体,并将这些底物配成混合溶液进行10×10组合式光生物催化反应。在这100种组合中,有5种自由基前体(1u, 1v, 1w, 1x 和 1y)和4种自由基受体(2k, 2l, 2m 和 2n)在前述图2–5的底物拓展实验中未曾探索,属于新增的未测试底物。使用UstDAWQ作为生物催化剂进行的组合反应结果显示,86%的底物组合可成功检测到相应的产物。这些转化中,28%的组合产物产率为30–80%,49%的组合产物产率在10–30%。与UstDAWQ相比,其他PLP酶变体如UstDAWMM、UstDAWLG和UstDAWLM也展现出互补性的底物选择性,在不同的底物组合中具有独特的催化表现。综合而言,这四种酶变体在本次的10 × 10组合反应库中覆盖了99%的产物,其中44%的化合物产率达到30–80%。进一步的化学信息学分析证实该酶催化组合合成库具有高度的结构多样性,展现出极大的化学空间覆盖能力。这一结果强调了酶工程在探索广阔化学空间方面的巨大潜力。与大多数酶系统表现出较强底物选择性不同,该研究提供了一个罕见案例,展示了一种高度底物宽容的生物催化反应体系,可在单一反应中组合三个不同的可变底物片段。这一体系在构建立体复杂、三维结构多样的分子骨架方面具有显著优势,凸显了其在多样性导向合成(DOS)中的重要价值,有望加速新颖化合物的开发,助力药物发现和分子创新。
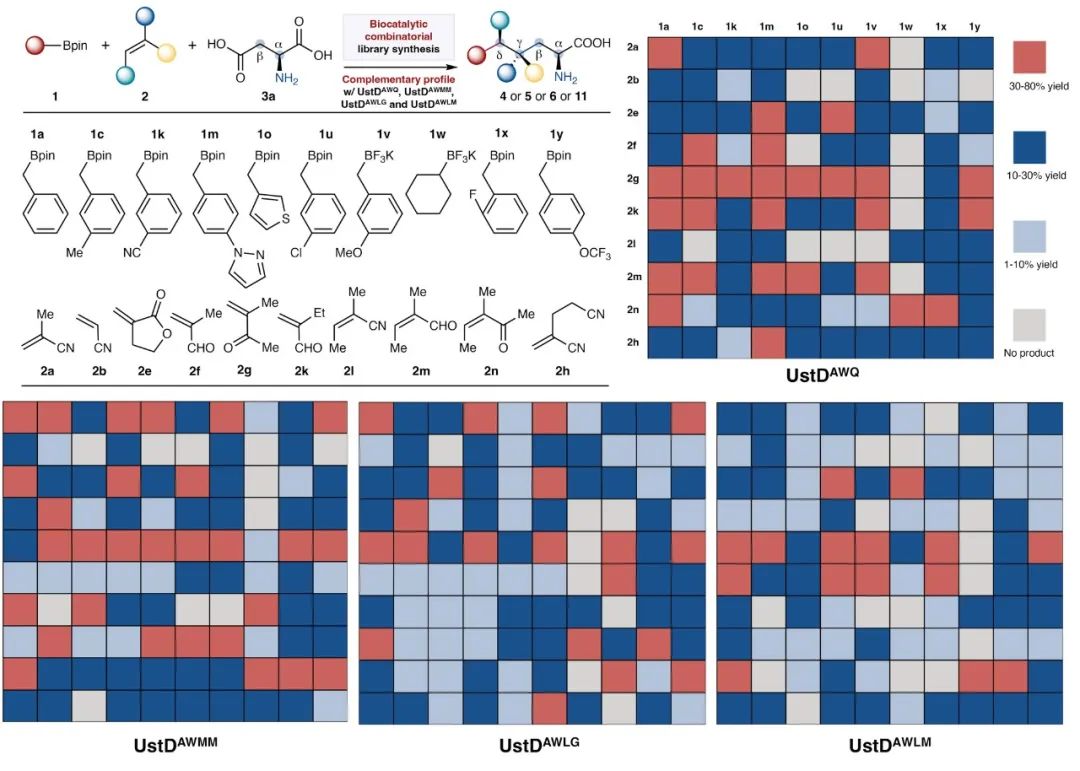
图6. 分子多样性导向的组合式酶催化合成
为了进一步探究反应机理,进行了一系列实验:对光催化剂RB和酶进行了紫外-可见吸收光谱分析,当RB与UstDAWMM以1:1比例混合后,观察到RB吸收峰发生明显红移(图7B),这一红移现象暗示RB所处的微环境因UstDAWMM的存在而发生改变。为了进一步验证RB与UstDAWMM之间的相互作用,进行了荧光各向异性滴定实验(图7C)。实验表明,RB与UstDAWMM会形成1:1复合物,其解离常数(Kd)为10.9±0.5 µM,表明两者结合能力较强。推测,光氧化还原生成的自由基会被靠近酶活性位点的自由基受体迅速捕获。受到疏水相互作用的引导,新产生的自由基接着扩散进入酶的活性位点,并与由酶稳定的PLP共价中间体高效偶联。最后,利用经典MD模拟进一步探究了UstDAWMM活性位点中,PLP-结合的烯胺与α-氰基自由基之间的分子相互作用。在UstDAWMM的活性位点内,烯胺的(Re)-面被残基K258阻挡,而(Si)-面则形成一个疏水性手性口袋,由残基M60、M392和W393围绕形成(图7D)。此外,残基H148与烯胺的(Si)-面位于同一侧,其侧链可通过π–π作用与PLP的吡啶环发生相互作用。进一步建立了酶促反应中两种趋近进攻构象(NACs)的模型,分别对应于烯胺对α-氰基叔烷自由基的(Re)-面与(Si)-面的加成路径,从而形成主要与次要的非对映异构体。在 (Re)-面加成的主导构象中,α-氰基自由的氰基与H148的N(ε)–H形成稳定氢键(图7E左)。同时,自由基的苯基与W393和H283′的侧链形成π–π堆积作用,而其小体积的甲基嵌入M392与M60之间的疏水口袋。这些非共价作用通过MD轨迹中的距离分析得到证实:CNradical···H–N(ε)H148为2.34 Å,πradical···πW393和πradical···πH283′的距离为4.76 Å和4.65 Å。相比之下,在(Si)-面加成路径中,自由基的苯基暴露于溶剂中,无法形成稳定的π–π堆积作用。而苯乙基侧链与M392及M60之间的疏水相互作用则引发了碳-碳成键构象的旋转,从而破坏了氰基与H148之间氢键的稳定性(图7E右)。在此路径中,CNradical···HH148距离增大至3.17 Å,表明该路径的构象不利于反应。综上所述,MD模拟结果表明,UstDAWMM中的S60M、L392M和M393W突变不仅强化了酶对自由基的有利非共价作用,从而提升反应活性,还通过收紧手性口袋实现了对甲基和苯乙基之间的空间立体识别,共同造就了该体系的高选择性表现。
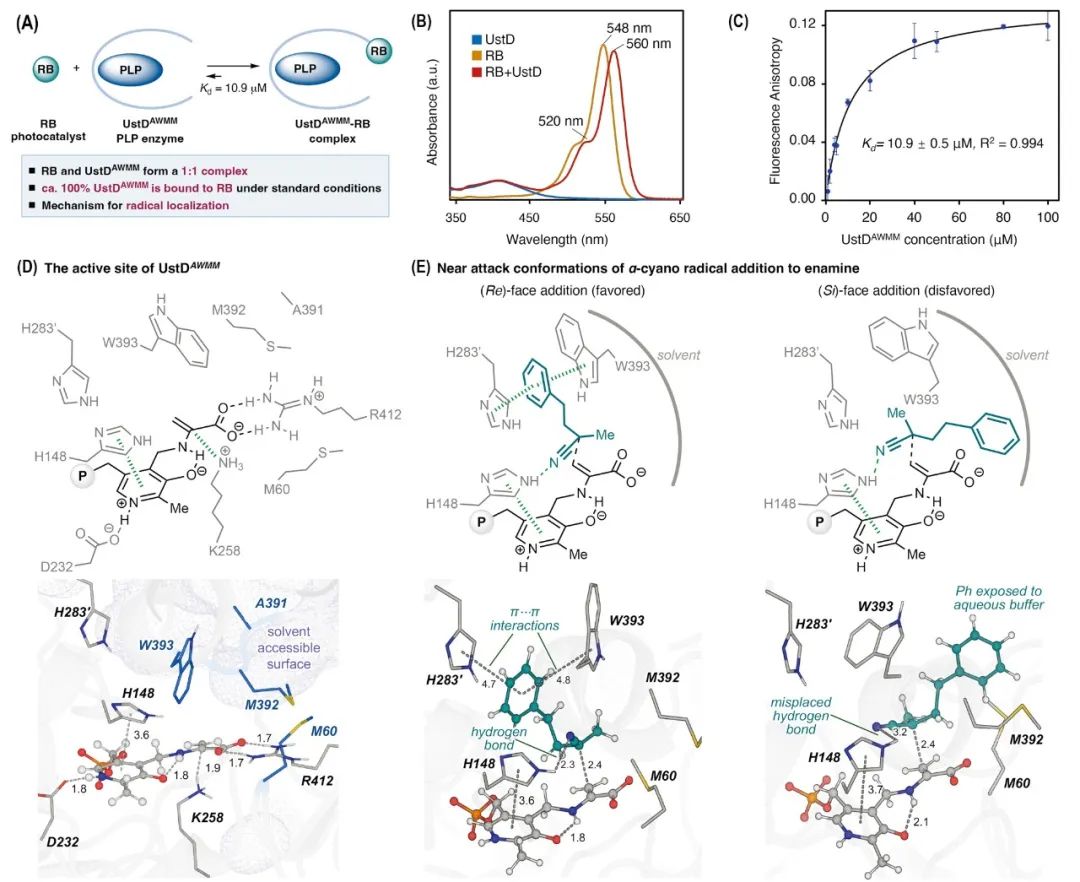
图7. 反应机理与计算化学研究
文中所用仪器设备
综上,研究团队利用光催化剂、天冬氨酸β-脱羧酶的协同催化作用,开发了一种可实现多样化手性氨基酸衍生物合成的光驱动三组分酶促自由基偶联反应,具有前所未有的底物广度和立体选择性。该研究展示了工程酶在构建复杂分子和推动药物发现中的巨大潜力。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




