【ACS Catal.】川大刘小华 : 碘介导的光氧化还原/Lewis酸协同催化甘氨酸酯的不对称交叉脱氢偶联反应
近日,四川大学刘小华教授团队与冯良文研究员合作在光催化甘氨酸酯α-C(sp3)–H官能团化构建非天然氨基酸上取得进展,相关成果“Asymmetric Cross-Dehydrogenative Coupling of Glycinates via Iodine-Mediated Photoredox/Lewis Acid Synergistic Catalysis” 以研究论文的形式发表于ACS Catalysis,四川大学化学学院为第一通讯单位,冯良文研究员和刘小华教授为共同通讯作者,博士研究生谭九七为论文第一作者。
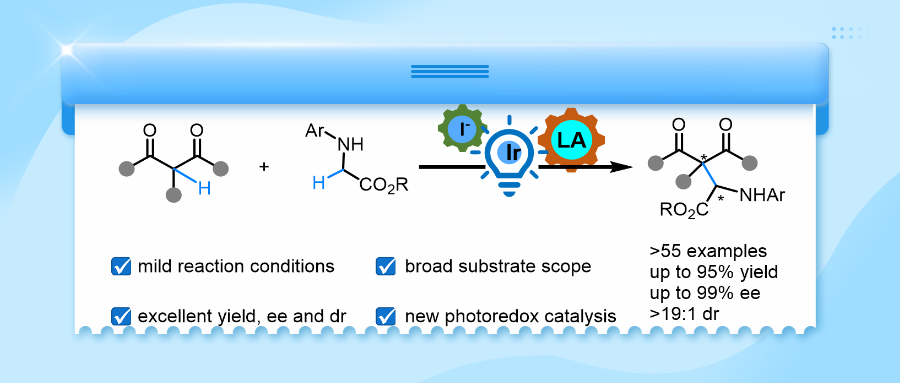
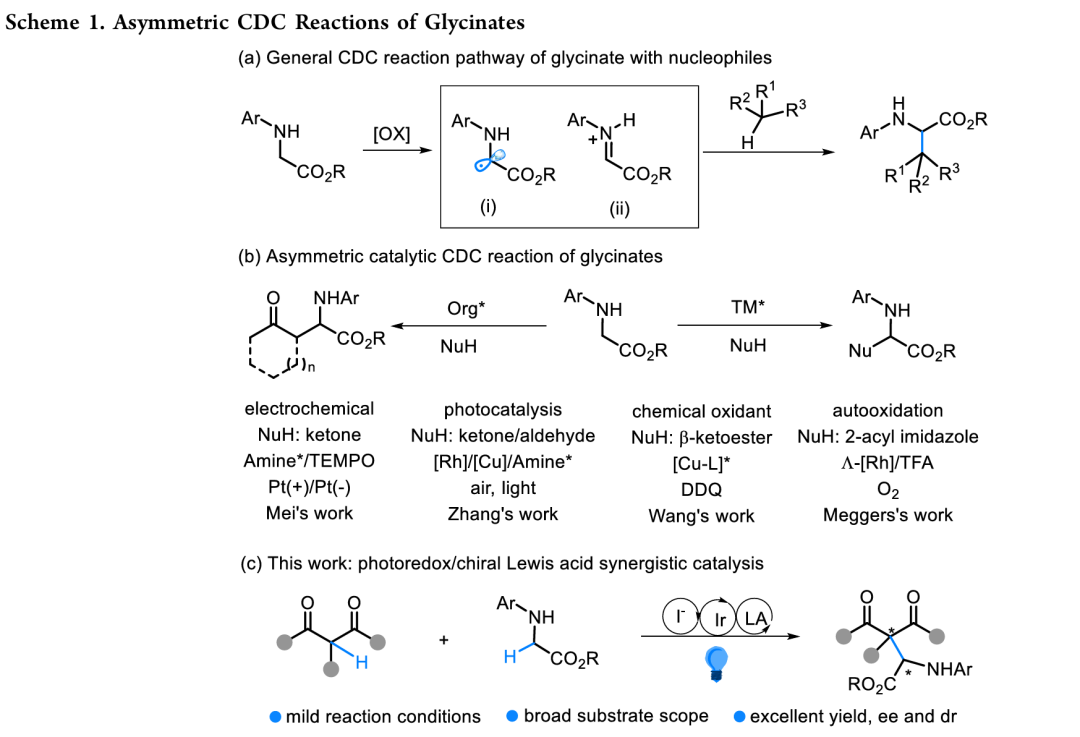
交叉脱氢偶联(CDC)反应作为一种革命性方法,通过直接偶联两个C(sp3)–H键实现C–C键的构建,无需底物预官能团化过程,同时兼具显著的原子经济性和步骤经济性优势。然而,该策略早期的发展受限于需使用化学计量强氧化剂及苛刻反应条件,这尤其限制了其催化不对称反应的发展。甘氨酸酯的直接CDC反应从反应机理角度分析可能经历两种途径:通过单电子氧化过程生成α-氨基自由基物种,或通过双电子氧化途径形成亚胺离子中间体(Scheme 1a),这些活性中间体可被亲核试剂捕获,最终生成手性氨基酸衍生物。
新型氧化方法的开发推动了不对称催化交叉偶联领域的发展。早期,黄志真课题组将手性胺与铜催化剂结合,以过氧化物为氧化剂开展研究,但所得对映选择性不甚理想(Angew. Chem. Int. Ed. 2010, 49, 10181.)。随后,这一协同催化策略被梅天胜课题组拓展至电化学合成领域(J. Am. Chem. Soc. 2021, 143, 15599.),张元课题组则将其应用于光催化自氧化体系(Chem. Sci. 2020, 11, 4741.)(Scheme 1b)。王锐课题组采用手性铜催化剂与DDQ氧化剂实现甘氨酸酯与β-酮酯的偶联,但其非对映选择性难以控制(Angew. Chem. Int. Ed. 2011, 50, 10429.)。龚磊和Meggers团队利用甘氨酸酯空气氧化特性与金属手性铑(III)催化剂,成功实现与2-酰基咪唑的偶联(Angew. Chem. Int. Ed. 2015, 54, 13045.)。这些体系可能是通过生成亚胺中间体,经极性Mannich反应获得产物,但十分受限于甘氨酸酯的取代基兼容性(尤其对吸电子N-芳基耐受性差),且存在酮酯竞争氧化导致同源偶联副产物的问题。基于对甘氨酸酯烷基化中自由基-自由基交叉偶联机制的认知,结合团队在甘氨酸酯自由基加成(Chem. Sci. 2024, 15, 16050.)方面的工作,团队认为可见光驱动的自由基途径虽面临高活性自由基物种立体控制难题,却有望拓展底物普适性并提升反应活性。为此,团队设计了一种新型的由碘离子介导的Ir(Ⅲ)光氧化还原/手性Mg(Ⅱ)配合物协同催化体系(Scheme 1c)。在可见光激发下,该体系以过氧化苯甲酸叔丁酯(TBPB)为氧化剂、催化量NaI为添加剂,实现了甘氨酸酯的高效不对称CDC反应,展现出优异的底物兼容性及立体选择性控制。
(来源:ACS Catal.)
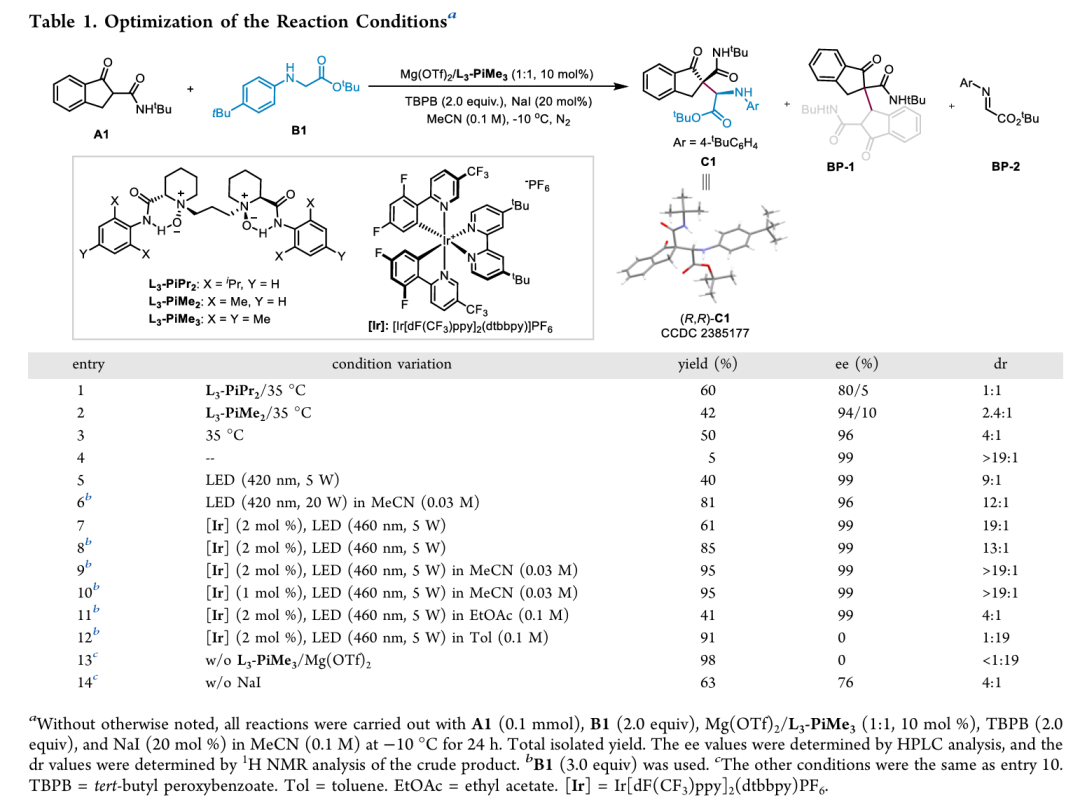
首先作者经过大量条件筛选,确定最优反应在-10℃,MeCN为溶剂,460nm 5 W Blue LEDs光照的氮气氛围条件下进行。手性Mg(OTf)2/L3-PiMe3配合物(冯催化剂)为Lewis酸催化剂,Ir[dF(CF3)ppy]2(dtbbpy)PF6为光催化剂,TBPB为助氧化剂,NaI为添加剂 (Table 1, entry 10)。可见光的引入能在低温下激活TBPB/NaI氧化剂,从而提高收率;光催化剂的引入能够加速反应决速步骤。有意思的是,溶剂极性能够影响反应的非对映选择性,在弱极性溶剂(如甲苯)中会发生dr值反转的现象。
(来源:ACS Catal.)
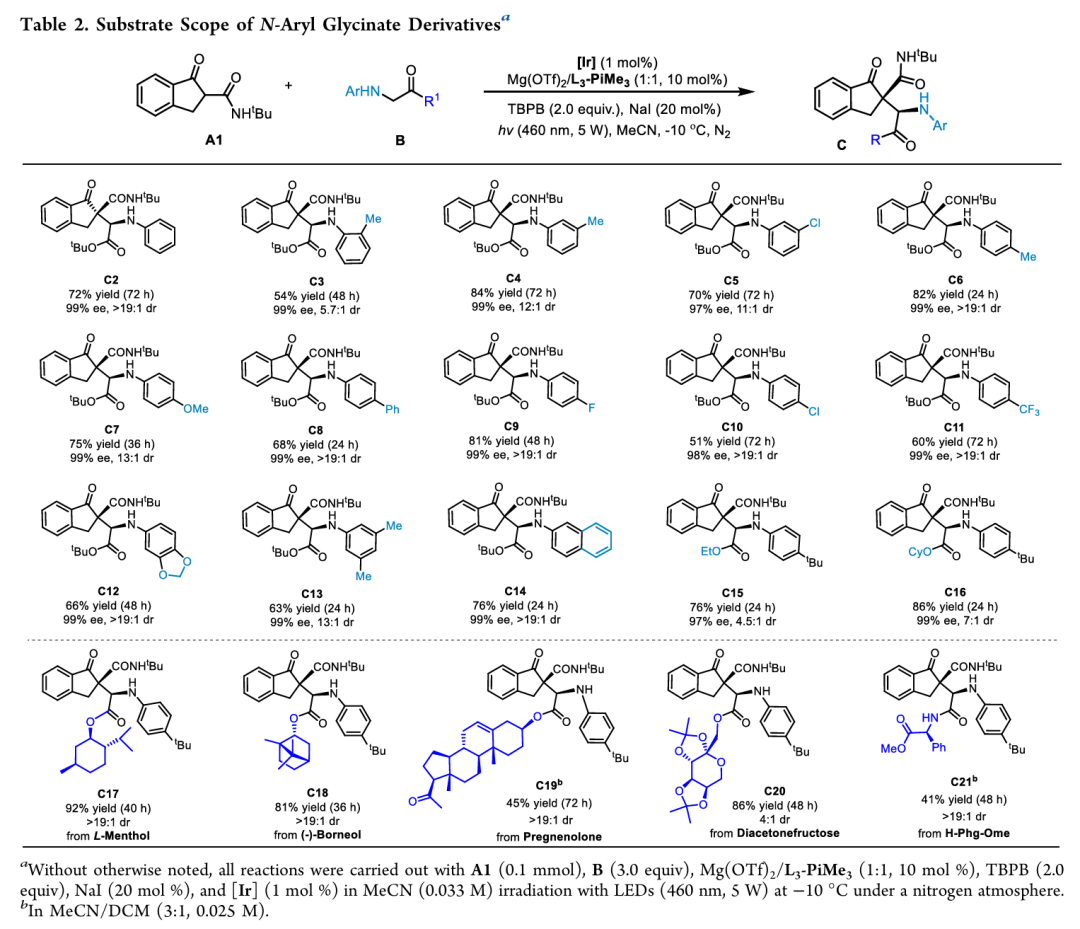
在获得上述最佳反应条件(Table1, entry 10)后,作者首先对各种取代甘氨酸酯进行考察 (Table 2)。芳基上不同位置取代基均能发生反应,且取代基的电子效应对反应的收率有略微影响并不改变反应的对映选择性(C1-C16)。除此之外,作者对醇类天然产物进行修饰,同时也能对多肽进行修饰(C17-C21)。
(来源:ACS Catal.)
随后,作者对环状和链状β-酮酰胺底物的普适性进行了考察(Table 3)。对于环状底物不管是茚酮衍生(C22-C42)还是四氢萘酮衍生(C43-C48)的底物都能很好的兼容。此外,简单烷基环状酮,如环戊酮(C50)、环己酮(C51)衍生物,也能顺利发生转化尽管反应活性有所降低。对于链状的α-氟代-β-酮酰胺底物在最优条件下也能高对映和非对映选择性得到目标产物(E1-E4)。
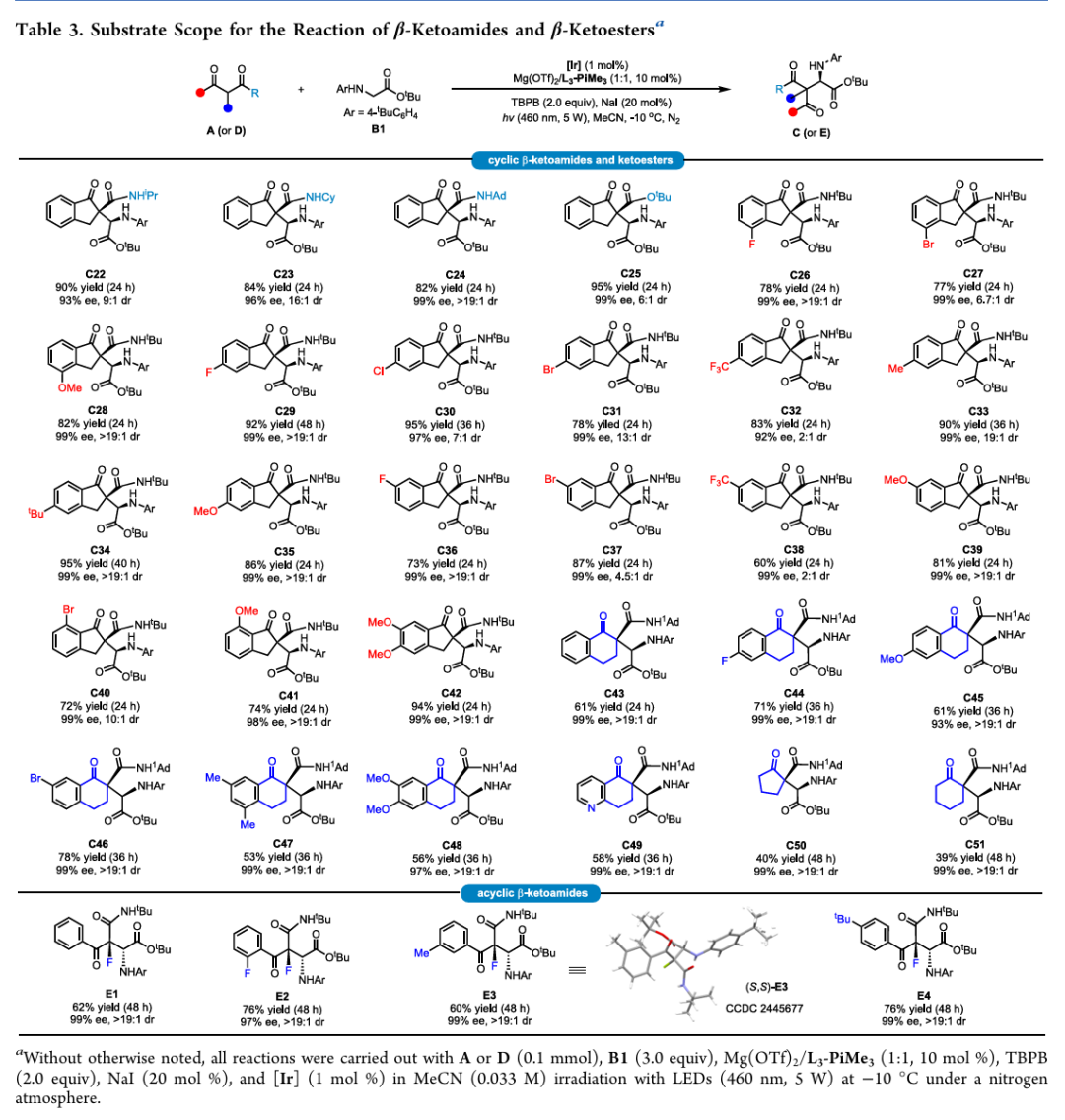
(来源:ACS Catal.)
为了展现该合成方法的有用性,作者首先进行克级规模放大实验,反应结果都能保持。此外,产物C7通过选择性还原可以转化为多种有价值的化合物,如β-氨基醇、内酯和沙芬酰胺类似物等,展示了该反应在合成复杂分子中的应用潜力;N-PMP保护基可以根据底物结构发生选择性脱保护和保留得到氨基和对醌亚胺产物。而氨基酮产物F1可以进一步发生还原、内酯化、酰胺缩合等转化,充分展示了该反应在合成复杂分子中的应用潜力 (Scheme 2)。
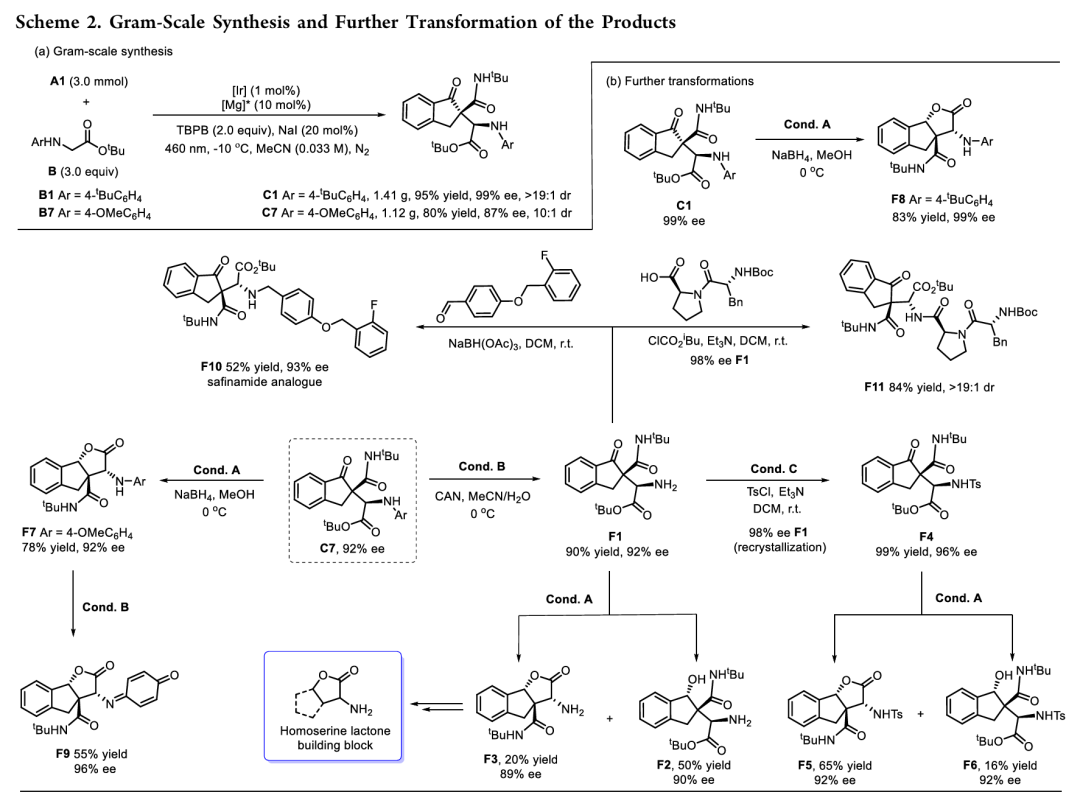
(来源:ACS Catal.)
为了详细探究该反应的机理,作者进行了深入的机理研究(Scheme 3)。自由基捕获实验说明了该反应可能经历不同于传统极性Mannich反应的自由基路径;控制实验说明两种底物的氧化路径是独立的,酮酰胺由TBPB/NaI氧化,甘氨酸酯的氧化由光催化循环完成,且通过亚胺底物的对照实验进一步排除了极性Mannich反应机理;动力学同位素效应实验展现出一级同位素效应,说明甘氨酸酯C-H断裂是决速步骤;紫外可见吸收光谱实验说明光催化剂和TBPB/NaI都能吸收可见光;荧光淬灭实验和循环伏安曲线验证了光催化剂由TBPB/NaI氧化淬灭;开关灯实验和荧光量子产率计算排除了自由基链式反应的可能性。
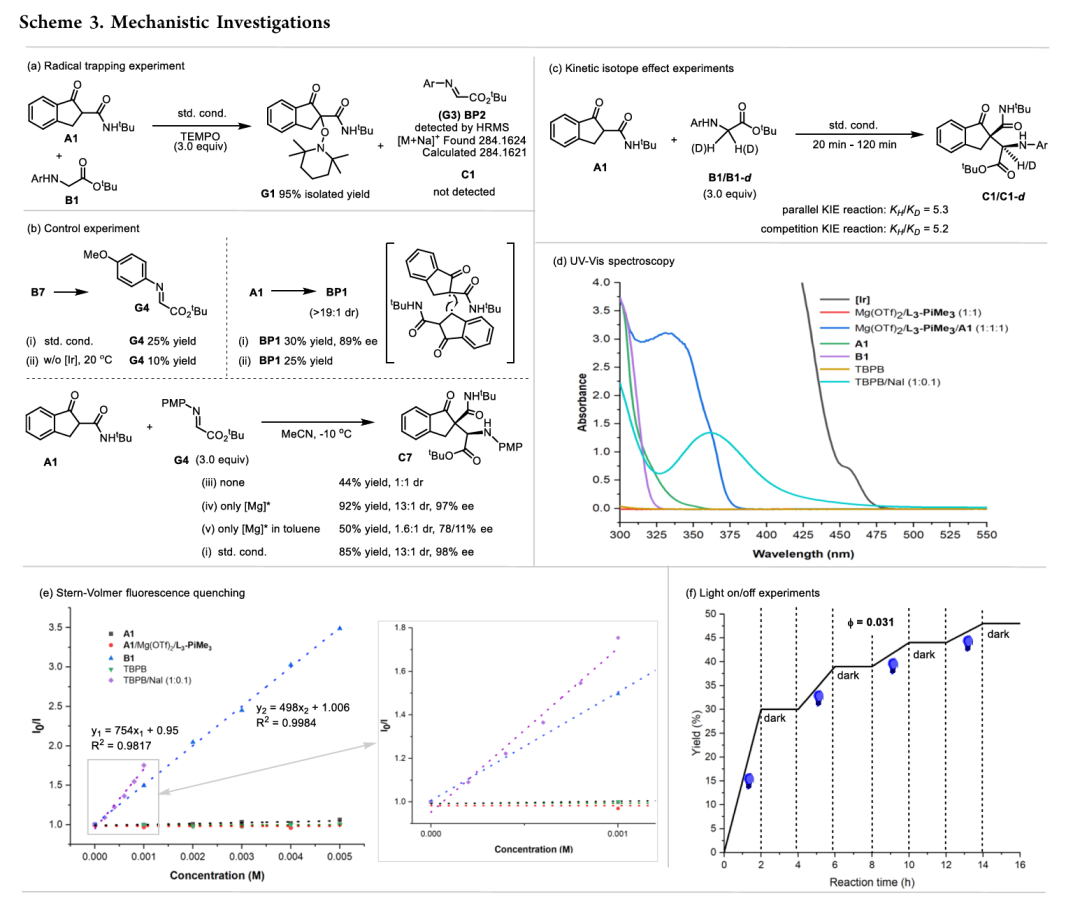
(来源:ACS Catal.)
基于上述机理实验分析,作者提出了一种可能的主导机制(Figure 1)。TBPB/NaI混合物生成了新的氧化性次碘酸盐物种ROI。在可见光照射下,激发态的*[IrⅢ]光催化剂与ROI发生氧化反应,生成氧化态[IrⅣ]物种并再生碘离子。[IrⅣ]催化剂将甘氨酸酯B1氧化成α-氨基自由基Int I(Eox (IrIV/IrIII) = +1.69 V)。光催化剂和TBPB/NaI的接力氧化有利于甘氨酸的α-C–H活化,这是决定反应速率的关键步骤。另一方面,手性路易斯酸双键结合的β-酮酰胺复合物(A1/[Mg])被TBPB或激发的*ROI物种氧化成手性路易斯酸绑定的碳自由基物种Int II。然后以对映和非对映选择性的方式从自由基Int II与亚胺离子G3-H+加成,得到自由基阳离子物种Int Ⅲ。最后,Int Ⅲ被还原态[IrⅡ]还原得到目标产物C1。此外,Int Ⅰ和Int Ⅱ之间的自由基交叉偶联也可以得到目标产物。同源偶联产物BP-1的形成机制可解释为:中间体Int II与其异构体Int IIʹ通过自旋中心转移(SCS)机制,以立体选择性的方式发生自由基偶联反应。
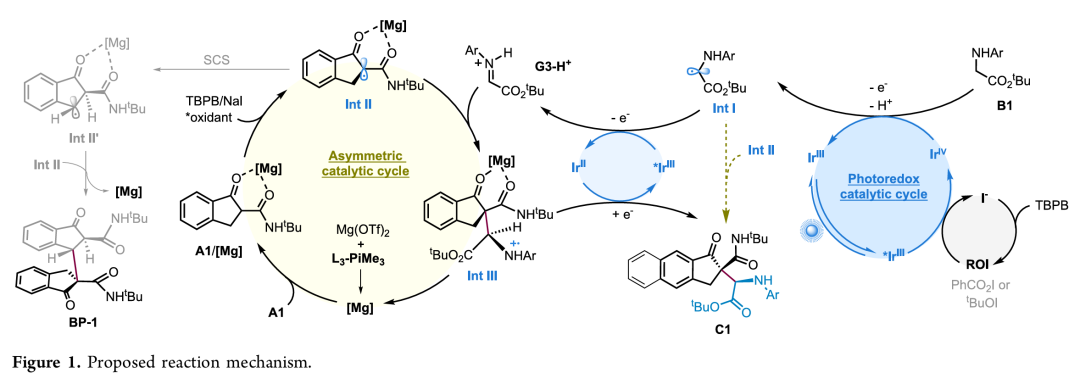
(来源:ACS Catal.)
此外,作者通过DFT计算进一步解释了该反应在无路易斯酸存在时非对映选择性的反转(Table 1,entry 13)的原因:与[Mg]键合的中间体Int II不同,A1的自由基物种通过分子内氢键得以稳定,此时两个羰基处于空间远离状态。TS-(S,R)过渡态因受氢键和C–H···π相互作用的稳定而更有利,而TS-(R,R)过渡态中这些相互作用显著减弱,从而导致外消旋(RS/SR)产物的高非对映选择性。当在甲苯中进行不对称反应时(Table 1,entry 12),分子内氢键作用较强,且底物与手性催化剂之间缺乏有效配位,最终生成外消旋(RS/SR)非对映异构体(Figure 2)。
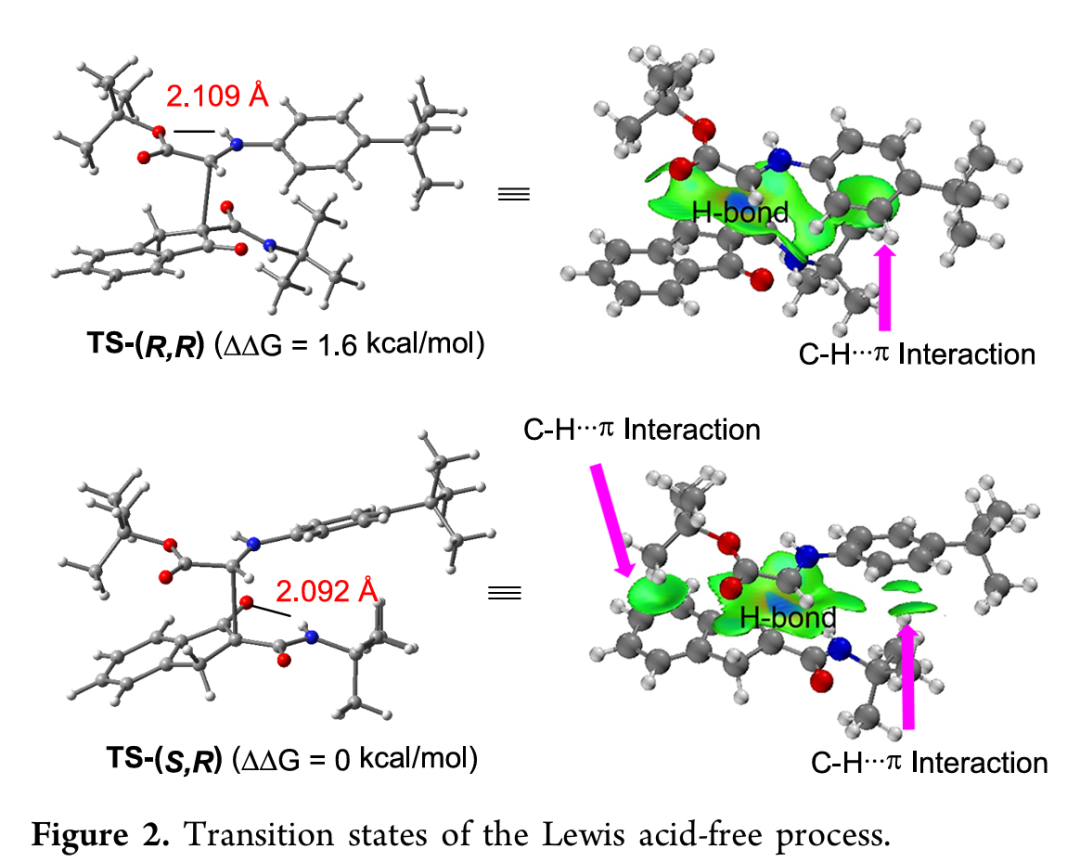
(来源:ACS Catal.)
综上,刘小华、冯良文合作团队发展了一种碘离子介导的铱光氧化还原催化剂和N,Nʹ-双氮氧手性镁配合物(冯催化剂)协同催化的方法,实现了甘氨酸酯不对称α-C(sp3)-H全烷基化和氟烷基化,构建一系列β-全碳-α-氨酸衍生物。
该工作得到国家自然科学基金和四川大学的经费资助。同时作者感谢周宇乔博士(四川大学)提供的X-射线单晶衍射分析。
论文信息:
Asymmetric Cross-Dehydrogenative Coupling of Glycinates via Iodine-Mediated Photoredox/Lewis Acid Synergistic Catalysis
Jiuqi Tan, Hanyu Su, Min Chen, Fengnan Xiao, Longqing Yang, Xiaoming Feng, Liang-Wen Feng,* and Xiaohua Liu*
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




