【Chem. Sci.】北大深研院刘杨斌/川大冯小明/湘大邵稳:光催化自由基张力释放/[3,3]-重排串联反应构建多取代环丁烷
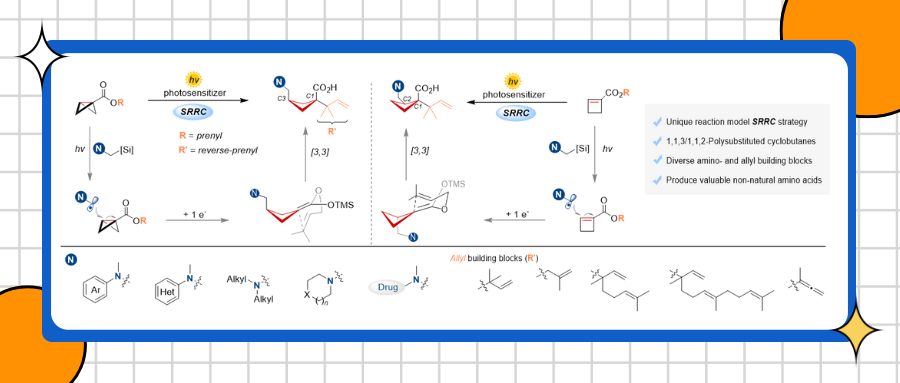
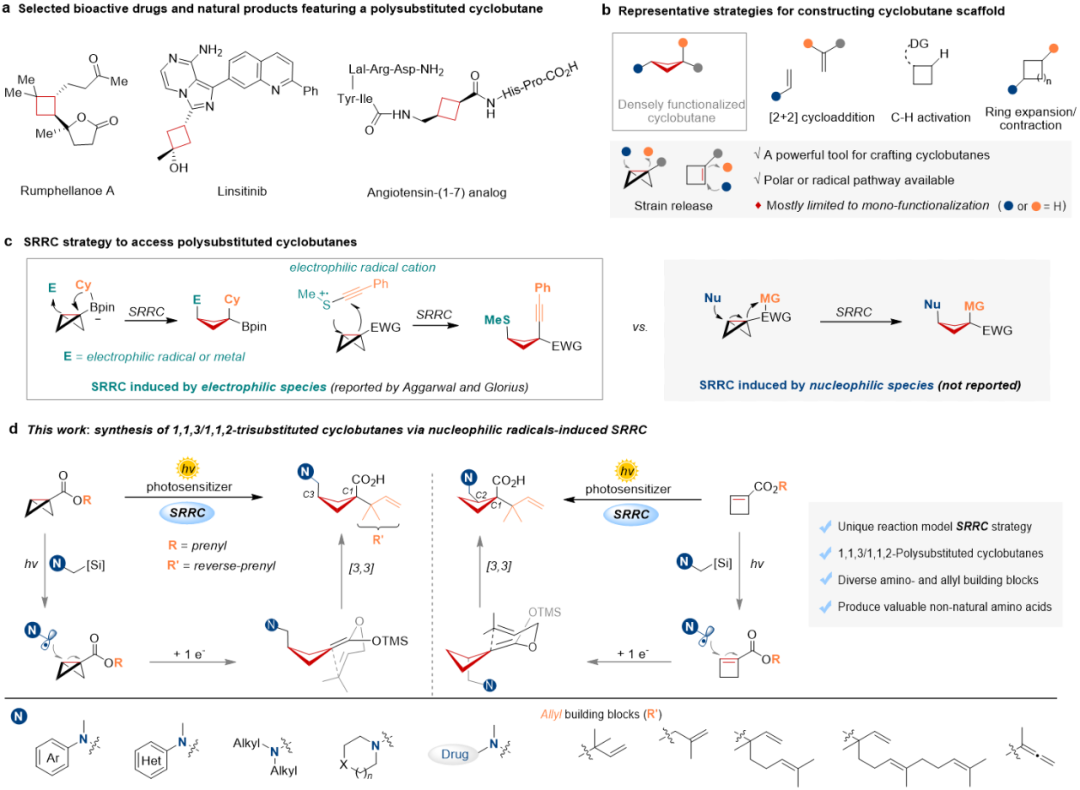
具有高三维结构特性和优异药理活性的多取代环丁烷骨架广泛存在于天然产物及药物分子中。近年来,双环[1.1.0]丁烷(BCBs)的张力释放驱动合成策略发展迅速,然而同时向BCBs引入两个官能团,快速实现多取代环丁烷的组装仍然面临重大挑战。最近张力释放/重排串联(SRRC)策略为BCBs的区域选择性双官能化提供了新途径,高效构建高度官能化的多取代环丁烷。Aggarwal与Glorius的开创性工作证实:通过缺电子物种(如芳基钯、烯丙基铱及亲电自由基)对BCB中张力C-C σ键的加成,可触发1,2-硼酸酯重排或炔基重排,进而制备1,3-双官能化的环丁烷。尽管SRRC策略取得这些进展,但其引发剂仍局限于亲电物种,而亲核物种诱导的SRRC转化仍亟待探索。
近日,北大深研院刘杨斌、四川大学冯小明联合团队在前期光催化自由基诱导的吲哚去芳构化/[3,3]-重排串联反应(Nat. Commun. 2023, 14, 3876)基础上,开发光催化亲核自由基诱导的SRRC策略,用于高效合成多取代环丁烷。该策略使用简单易得的α-硅基叔胺作为自由基前体,对高张力的双环[1.1.0]丁烷(BCBs)或环丁烯进行加成,经单电子还原生成硅基烯酮缩醛中间体后,触发分子内Claisen型[3,3]-重排,从而高效构建含非天然氨基酸骨架的1,1,3-及1,1,2-三取代环丁烷化合物。该SRRC反应的关键挑战在于活性烯酮缩醛中间体的[3,3]-重排与质子化过程的竞争调控。
(来源:Chem. Sci.)
具有高三维结构特性和优异药理活性的多取代环丁烷骨架广泛存在于天然产物及药物分子中。近年来,双环[1.1.0]丁烷(BCBs)的张力释放驱动合成策略发展迅速,然而同时向BCBs引入两个官能团,快速实现多取代环丁烷的组装仍然面临重大挑战。最近张力释放/重排串联(SRRC)策略为BCBs的区域选择性双官能化提供了新途径,高效构建高度官能化的多取代环丁烷。Aggarwal与Glorius的开创性工作证实:通过缺电子物种(如芳基钯、烯丙基铱及亲电自由基)对BCB中张力C-C σ键的加成,可触发1,2-硼酸酯重排或炔基重排,进而制备1,3-双官能化的环丁烷。尽管SRRC策略取得这些进展,但其引发剂仍局限于亲电物种,而亲核物种诱导的SRRC转化仍亟待探索。
近日,北大深研院刘杨斌、四川大学冯小明联合团队在前期光催化自由基诱导的吲哚去芳构化/[3,3]-重排串联反应(Nat. Commun. 2023, 14, 3876)基础上,开发光催化亲核自由基诱导的SRRC策略,用于高效合成多取代环丁烷。该策略使用简单易得的α-硅基叔胺作为自由基前体,对高张力的双环[1.1.0]丁烷(BCBs)或环丁烯进行加成,经单电子还原生成硅基烯酮缩醛中间体后,触发分子内Claisen型[3,3]-重排,从而高效构建含非天然氨基酸骨架的1,1,3-及1,1,2-三取代环丁烷化合物。该SRRC反应的关键挑战在于活性烯酮缩醛中间体的[3,3]-重排与质子化过程的竞争调控。

(来源:Chem. Sci.)
综上所述,作者发展了一种光氧化还原介导的亲核自由基张力释放/[3,3]-重排策略,成功构建了多取代环丁烷体系。该策略以双环[1.1.0]丁烷和环丁烯作为自由基受体,以α-硅基叔胺作为自由基给体,高效合成了一系列含有非天然氨基酸骨架的1,1,3-及1,1,2-三取代环丁烷衍生物。机理研究表明,硅基烯酮缩醛中间体的关键反应活性源于张力释放自由基加成及后续的单电子还原过程。理论计算表明[3,3]-σ重排过渡态中的位阻效应是选择性地得到反式1,1,2-三取代环丁烷产物的原因。
该研究成果近期以“Synthesis of polysubstituted cyclobutanes through a photoredox strain-release/[3,3]-rearrangement cascade”为题发表于Chemical Science 。北大深研院博士生张方青和湘潭大学硕士生徐淳为共同第一作者,湘潭大学邵稳教授、四川大学冯小明教授与深圳湾实验室启航学者刘杨斌(现入职北京大学深圳研究生院)为共同通讯作者。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




