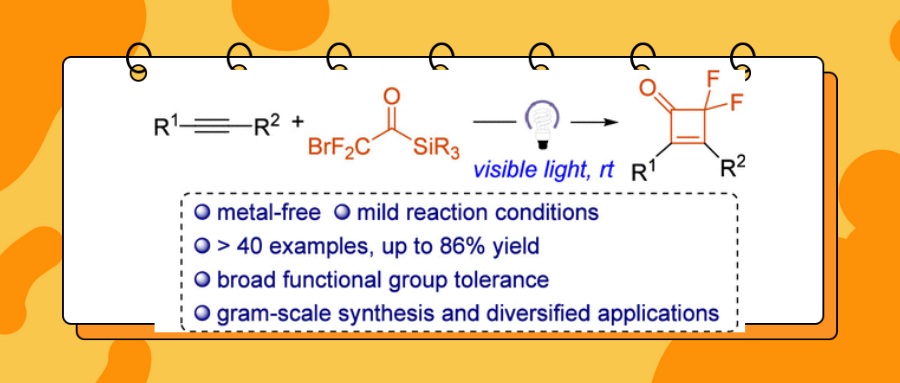
【JACS】武大沈晓课题组: 可见光诱导溴二氟酰基硅烷与炔烃的[2+2]环加成反应:偕-二氟环丁烯酮的高效构建
环丁烯酮因其独特的环张力结构和共轭的C=C与C=O键组合,在化学领域受到了广泛关注。这些化合物通过两种主要的反应模式展现出卓越的合成潜力:(i) 开环转化(包括热解、光解和过渡金属催化的反应),生成高度活性的中间体,随后可被各种亲核试剂、亲双烯体试剂和不饱和π体系捕获;(ii)通过亲核加成、还原和取代反应直接进行官能团修饰。同时,由于氟烷基单元引入到母体分子中赋予了特殊的化学、物理和生物特性,有机氟化合物在医药和材料科学领域引起了广泛的关注。战略性地引入氟已成为现代药物设计的基石,这一点在临床成功的多种治疗领域的药物中得到了体现,包括抗抑郁药氟西汀、抗癌药氟维司群、抗生素氟红霉素和抗逆转录病毒药物依法韦仑。在此背景下,构建偕-二氟环丁烯酮化合物尤为重要,因为这些化合物可以通过后续官能团化反应,为构筑多样化有机氟化物提供了理想的分子骨架。尽管它们具有合成潜力,但二氟环丁烯酮的合成却鲜有报道。1976年,Chambers及其同事报告了四氟代环丁烯与五氟化锑反应,随后在低温下用甲醇淬灭,得到微量的偕-二氟环丁烯酮(图1b)。随后,Smart及其同事报道了四氟代环丁烯与五氟化锑的反应,得到67%产率的偕-氟环丁烯酮(图1c)。然而,尽管有这些早期的工作,目前还没有广泛适用于偕-二氟环丁烯酮的合成方法。
最近,武汉大学沈晓课题组报道了一种简单高效的合成方法,用于从炔烃和溴二氟酰基硅烷出发,在可见光诱导的条件下,通过原位生成的二氟烯酮中间体进行环化反应,从而合成偕-二氟环丁烯酮。该反应条件温和,底物范围广泛,包括芳香族和脂肪族炔烃。此外,该反应表现出良好的官能团耐受性以及多种下游转化的潜力,同时易于实现克级规模放大。机理研究表明,溴二氟酰基硅烷作为二氟烯酮的光化学前体。
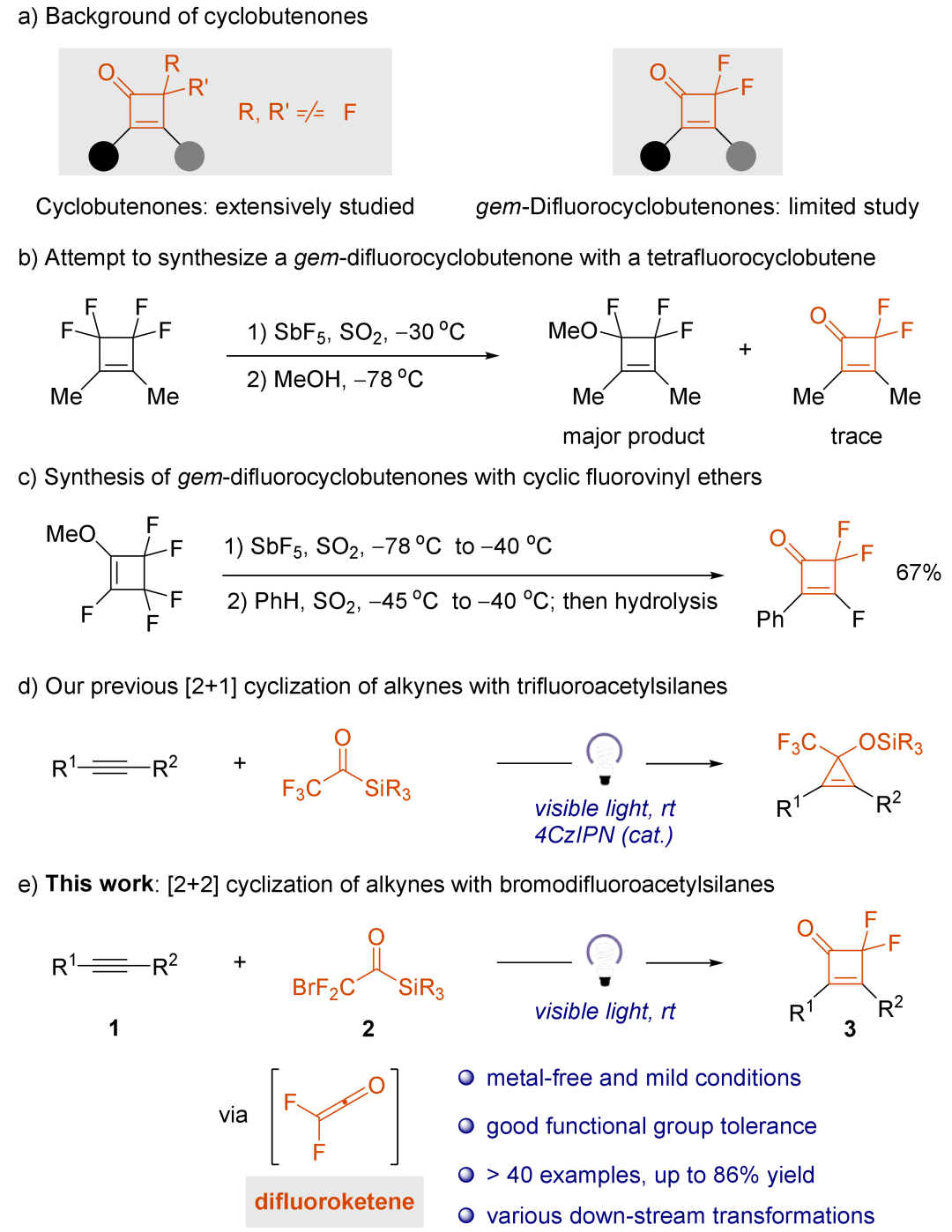
图 1:研究背景与合成策略(来源:J. Am. Chem. Soc.)
在最优的反应条件下,作者对不同的炔烃底物进行了拓展。各种二芳基炔烃都能成功地与试剂2a反应,生成了所需的[2 + 2]环化产物3a−3i,产率为37−85%。值得注意的是,由于炔烃在DCE中的溶解度较差,化合物3b−3i需要较低的浓度和更长的反应时间。进一步研究表明,底物的位阻效应可能影响反应效率。具体而言,对甲基和间甲基取代的二芳基炔烃比邻甲基取代的二芳基炔烃提供了更高的产率。该反应也可以兼容给电子的OMe以及吸电子的三氟甲基,分别以79%的产率和82%的产率得到3g和3h。对于含有OMe(供电子)和CF3(吸电子)的非对称的芳基-芳基底物,化合物3j能以44%的收率分离出来,区域选择性比为55:45。
随后,在标准条件下研究了芳基烷基炔烃的反应范围,该反应以55%的收率生成了二氟环丁酮3k。受胡金波课题组报道TBAB促进C−Si键断裂的启发,作者在反应中引入了1当量的TBAB,这使得3k的收率提高到65%。他们进一步优化反应条件,将炔烃降至3当量和增加TBAB至2当量,3k的收率提高至71%。重要的是,在没有光照的情况下,即使在存在TBAB的条件下,也没有观察到3k的生成。进一步的研究表明,反应能够耐受多种官能团,包括C(sp2)-OMe(3o,67%),C(sp2)-F(3p,79%),C(sp2)-Cl(3q,81%),C(sp2)-Br(3r,80%),C(sp2)-CF3(3y,74%),C(sp2)-CO2Me(3z,67%),C(sp2)-COMe(3aa,60%),C(sp2)-CN(3ab,59%),C(sp2)-SO2Me(3ac,51%),C(sp2)-CHO(3ad,48%),C(sp2)-TMS(3ag,63%),以及C(sp2)-SMe(3ah,81%)。有趣的是,底物芳香环上的不同甲基取代基对反应效率影响不大(化合物3s−3u,产率69−76%)。该反应能兼容耐基和噻吩,分别生成产物3ai (52%的产率)和3aj (52%的产率)。然而,TBAB的加入阻碍了与三甲基(苯乙炔基)硅烷的反应,可能是因为在反应条件下C(sp)-Si键不稳定(9%的产率对比3ak的27%产率)。幸运的是,当溶剂更换为MeCN时,目标化合物3ak以44%的产率获得。此外,与二烷基炔反应生成产物3al,产率为47%。对于末端脂肪族炔烃,反应也能进行,生成化合物3am−3ap,产率为27−60%。遗憾的是,该反应不能兼容苯乙炔,产生了未鉴定的复杂混合物。通过X射线单晶分析确定了化合物3r的结构。
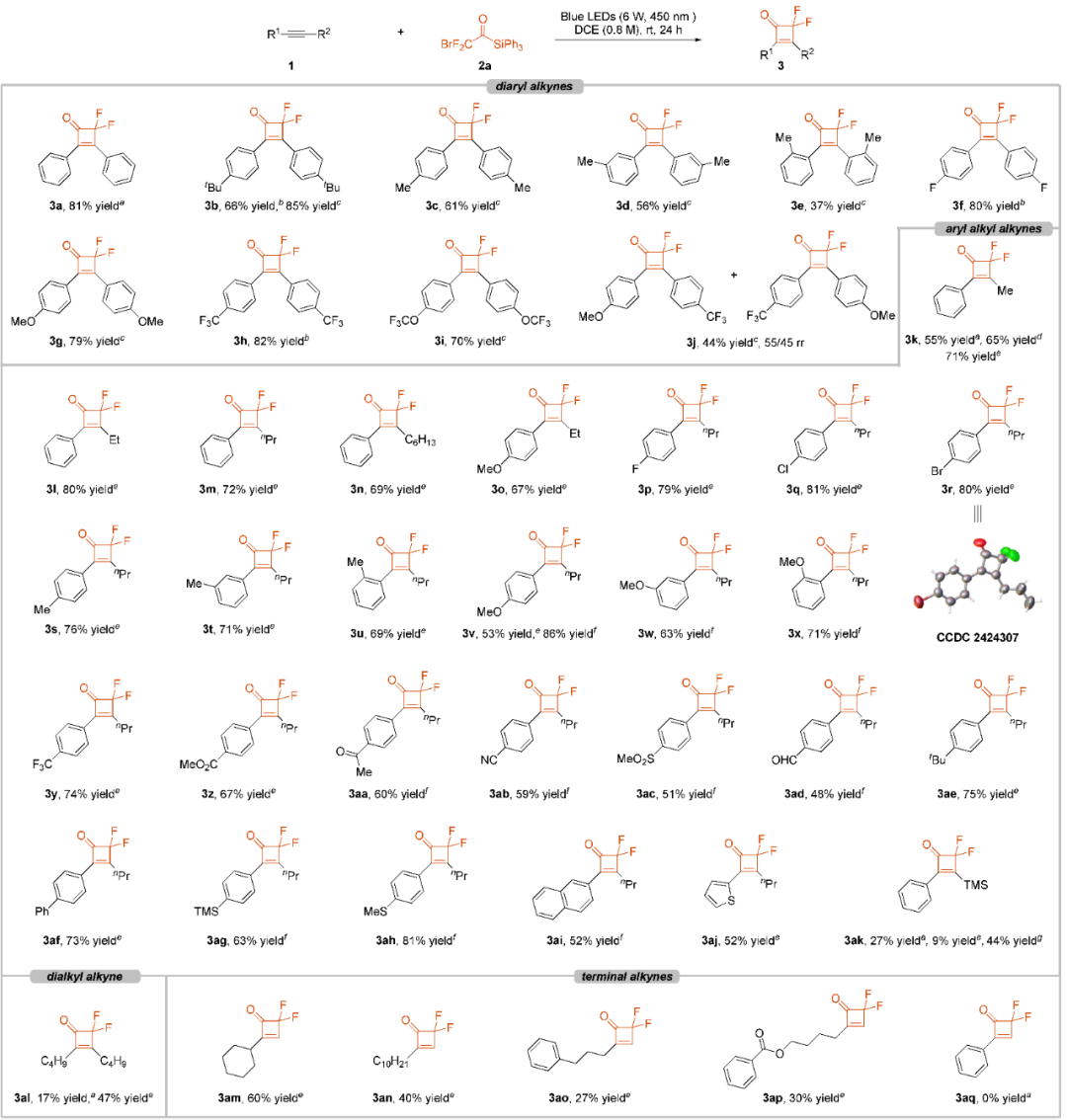
图2:底物拓展(来源:J. Am. Chem. Soc.)
随后作者进行了该反应的克级规模放大,当在7.5 mmol规模下进行时,化合物3a能以69%的收率(1.32 g,图3a)获得。值得注意的是,反应后回收了74%的底物1a(图3a)。为了展示该方法的合成潜力,进行了多种下游转化(图3b)。使用硼氢化钠对3a中羰基进行了选择性还原,得到醇4,收率为76%。3a与Wittig试剂反应生成二烯5,收率为68%。Grignard加成反应分别以79%和82%的收率生成化合物6和7。3a可以与丁二酸二甲基酯发生分子间的[2 + 2]环化反应,生成了螺化合物8,产率为53%。3a与PhSO2NHNH2缩合反应生成了腙9,产率为60%。在硫酸存在下,2a被水解,生成了3,4-二苯基环丁-3-烯-1,2-二酮10,产率为82%。此外,化合物3aj在TBAF的作用下脱硅,得到化合物11,产率为76%。作者还研究了氟取代对[2 + 2]环化反应的影响(图3c)。当溴单氟酰基硅烷作为底物时目标化合物3a′能以33%的收率被分离出来,说明单氟烯酮中间体是可以生成并参与反应的。值得注意的是,在440 nm照射下,可将收率提高到40%。相比之下,在相同条件下,未氟化的溴乙酰基硅烷2i作为底物时,未能得到目标产物3a″。
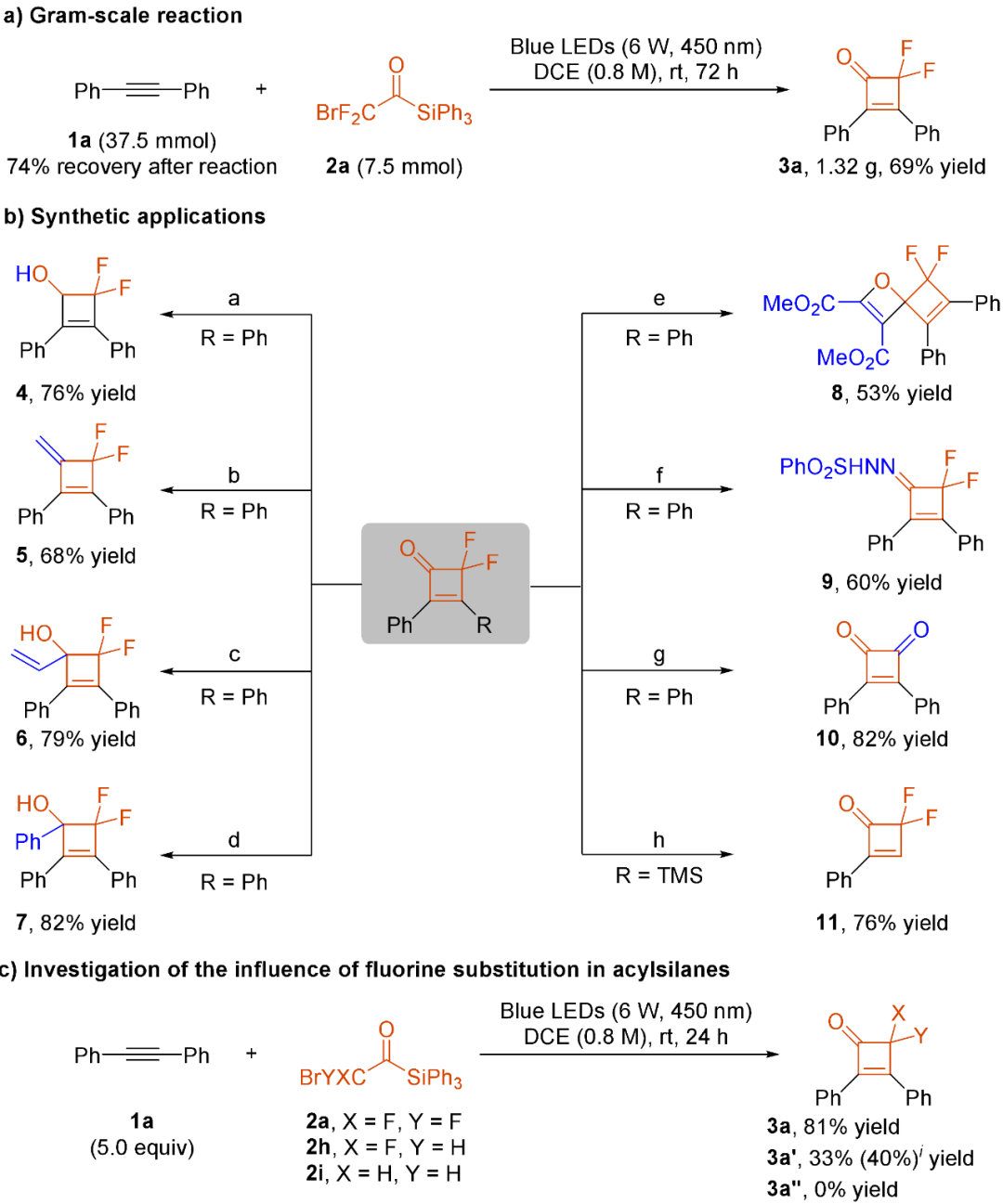
图3:克级反应、合成应用及氟取代的影响(来源:J. Am. Chem. Soc.)
为了探究二氟烯酮是否参与了反应,作者考察了苯胺和溴二氟酰基硅烷2a在450 nm光照条件下的反应(图4a)。酰胺13以54%的收率被分离出来,证明了反应体系中可能生成了二氟烯酮中间体。相比之下,在黑暗条件下,12和2a的反应中未观察到化合物13(图4b),这突显了光在二氟烯酮形成中的关键作用。此外,作者发现当在标准条件下引入1.5当量的TEMPO时,反应完全被抑制,二氟烷基自由基的被TEMPO的捕获产物14以45%的收率被分离出来(图4c)。另外,当加入1当量的烯丙基砜时,3a的收率降至15%,自由基氟烷基化产物16以21%的收率被分离出来(图4d)。这些实验结果表明2a在反应中发生了C-Br键的均裂,产生二氟烷基自由基和溴自由基。这一假设也得到了C-Br键的键离解能(56.5 kcal/mol)低于试剂2a中C-Si键的键离解能(77.8 kcal/mol)的支持。此外,对1a、2a及其混合物进行UV−vis光谱分析,未检测到电子供体−受体(EDA)复合物的形成。根据这些实验和计算结果,作者提出了一种可能的机制(图4e)。在光照的条件下,溴二氟酰基硅烷会生成溴自由基和二氟烷基自由基,随后释放出硅溴化物形成二氟烯酮。这一中间体随后会发生[2 + 2]环化反应,最终生成偕-二氟环丁烯酮。
此外,在芳基烷基炔烃反应中,仅观察到一种区域异构体。为了阐明这种区域选择性的来源,作者对局部亲核性(Nk)和亲电性(ωk)指数进行了计算分析。主要发现包括以下几点:(1)对于1-苯基-1-丙炔(1k),计算出的Nk值为0.43 eV(C1)对比0.01 eV(C2),表明C1的亲核性显著更强;(2)对于二氟烯酮,ωk值为0.58 eV(C3)对比0.31 eV(C4),显示C3的亲电性增强。这些计算结果提供了有力证据,证明[2 + 2]环加成反应通过C3(更亲电中心)上的C1(更亲核中心)的亲核进攻进行,完全符合观察到的区域异构体的形成。
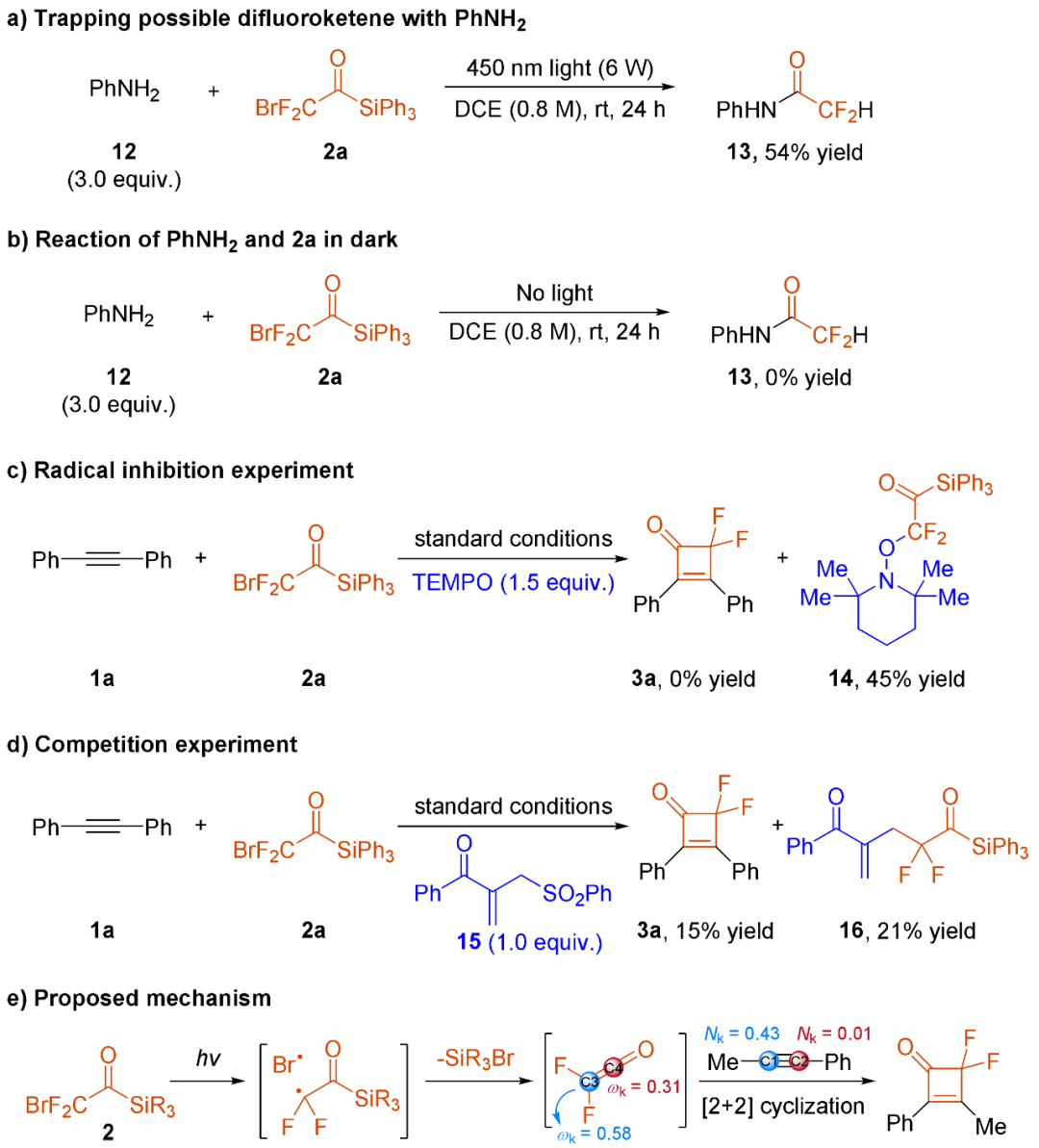
图4:机理研究(来源:J. Am. Chem. Soc.)
在该工作中,沈晓教授团队开发了一种高效的方法,通过可见光诱导的形式上[2 + 2]环化反应,利用易得的炔烃和溴二氟酰基硅烷,实现了偕-二氟环丁烯酮的高效构建。该反应条件简单,底物范围广泛,官能团耐受性良好。该方法的合成实用性通过一系列下游转化得以进一步证明。易于制备的偕-二氟环丁烯酮将进一步促进生物活性氟分子的合成研究。博士后周刚和硕士研究生李永鹏为该文的共同第一作者。该研究得到了科技部、中央高校基本科研业务费和国家自然科学基金委的支持。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




