【Angew. Chem.】武大沈晓课题组:通过光催化自由基Brook重排实现α-氟烷基醇的立体汇聚式合成
作为有机化学中的经典反应,阴离子Brook重排的核心特征在于碱介导下,硅基从碳原子向氧原子发生分子内1,2-阴离子迁移。这一经典的[1,2]-硅基迁移过程已在合成方法学中获得广泛应用(图1a)。相比之下,自由基Brook重排的研究显著较少,主要是由于在温和条件下可控生成和操纵烷氧基自由基的挑战性大(图1b)。2017年,Smith及其同事通过光催化实现了α-硅基醇的氧化Brook重排,但未直接观察到烷氧基自由基中间体。武汉大学沈晓课题组在其过渡金属催化的自由基Brook重排研究的基础上,通过可见光催化生成烷氧基自由基建立了稳健的自由基Brook重排体系,成功将其应用于环丁醇、单氟环己烯和功能化环戊醇的合成。随后,张前、舒超、汪清民、Glorius等团队的工作进一步拓展了自由基Brook重排在合成转化中的应用范围。尽管这些进展显著,且可见光光催化在现代合成中日益重要,但涉及自由基Brook重排的对映选择性交叉偶联反应仍未见报道(沈晓等人,Chem. Soc. Rev.2025, 54, 1870-1904)。
氟原子的引入是调节生物活性分子化学、物理和生物学性质的常用策略。其中,手性α-芳基-α-三氟甲基醇尤为重要,是奥达那卡替、LX-1301、替洛司他乙酯和贝氟沙酮等多种药物活性分子的关键结构单元。传统合成方法通常依赖双电子过程(如羰基化合物的亲核加成)。MacMillan等人的开创性工作通过醇的α-C(sp³)-H官能化实现了外消旋醇的合成,其自由基策略在官能团兼容性上优于传统极性反应。Phipps和Wang分别通过氢键相互作用介导的对映选择性Minisci反应和酰化反应推动了不对称自由基化学的发展,但这些策略仍局限于特定底物。Bandini团队报道了镍催化芳基卤化物与酮基自由基交叉偶联合成α-芳基-α-三氟甲基醇的唯一实例,但ee值仅为7%(图1c)。
武汉大学沈晓课题组在本研究中提出了一种创新策略,通过首次将光催化自由基Brook重排应用于对映选择性交叉偶联反应,实现了手性氟代烷基醇的不对称合成(图1d)。该催化体系具有优异的官能团耐受性和对映控制(高达99% ee)。机理研究表明,有机硅试剂芳环上的供电子甲氧基取代基通过降低氧化电位,对自由基Brook重排至关重要。
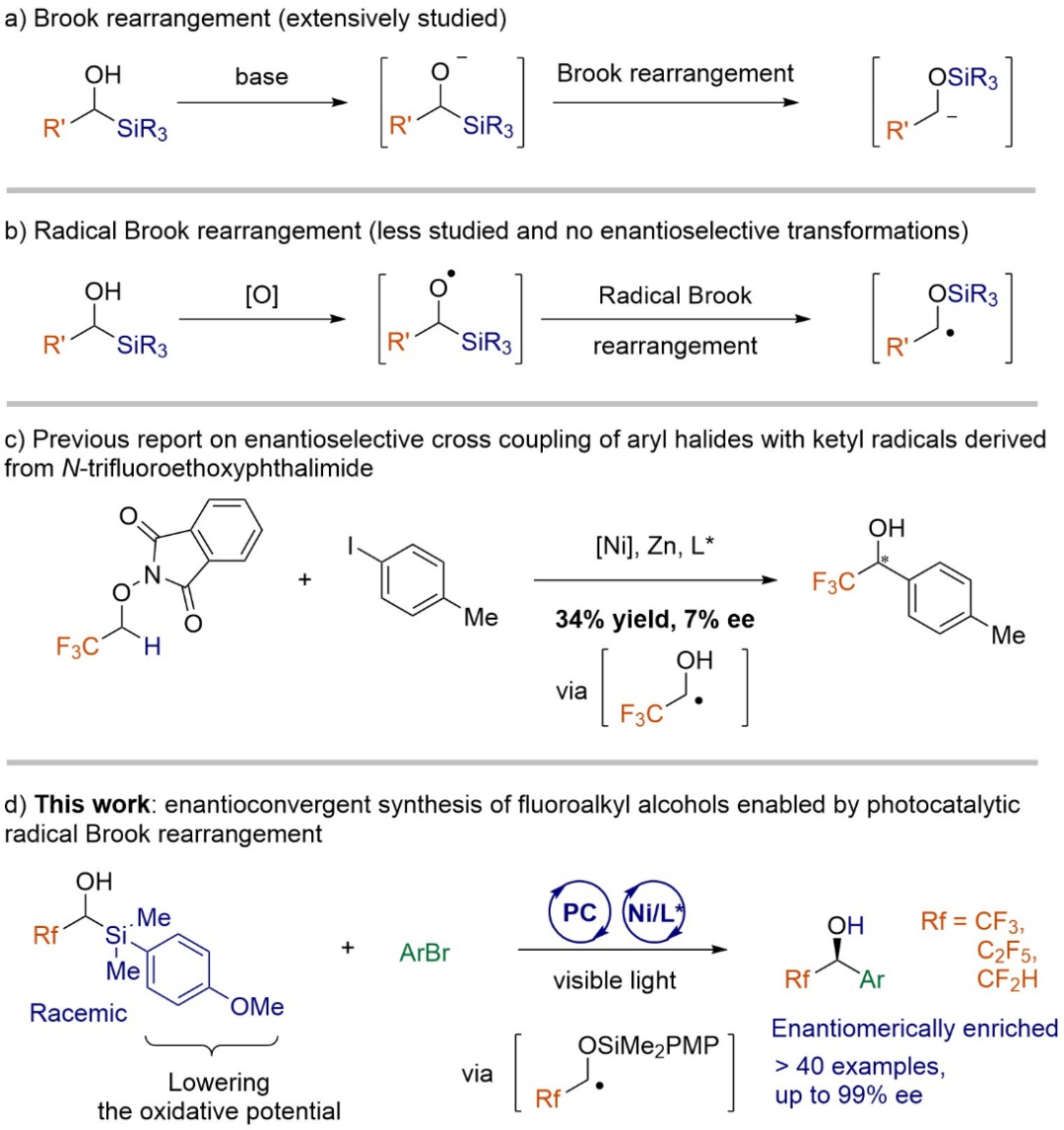
图1. 研究背景与沈晓课题组手性氟烷基醇的研究成果(来源:Angew. Chem.)
本研究通过光催化自由基Brook重排与镍催化不对称交叉偶联的结合,首次实现了α-氟代烷基醇的立体汇聚式合成(图1d)。关键突破在于设计含对甲氧基苯基(PMP)的硅烷试剂2g,其氧化电位显著降低,从而促进质子耦合电子转移(PCET)过程。经过配体优化,使用手性配体L6可将产物3a的收率提升至84%(分离收率83%),对映选择性达96% ee(图2a)。
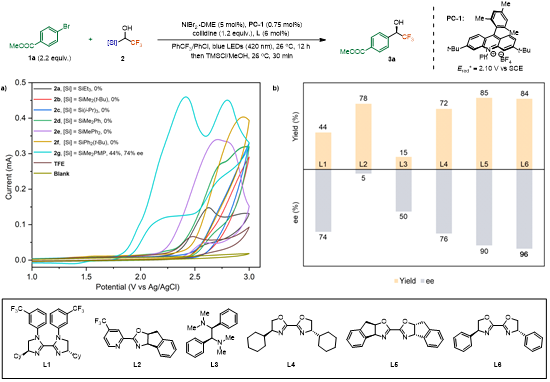
图2. 条件优化(来源:Angew. Chem.)
在优化条件下,多种芳基溴化物均能高效参与反应,生成α-氟烷基醇(3a–3z),收率41%-86%,对映选择性87%-99% ee(图3)。反应对吸电子基(如CO2Me、CN、F、CHO、COMe、CF3、OCF3、Cl、COCF3、COPh、SO2Me、Br)和供电子基(如OMe、CH₂CN)均表现出良好耐受性。值得注意的是,传统双电子过程中易受干扰的羰基底物(如3d、3e、3g、3i、3p、3q和3r)在此反应体系中很好的兼容。此外,杂芳基溴化物(如吡啶、苯并噻吩衍生物)和生物活性分子(如薄荷醇、磺胺二甲氧嘧啶)也有很好的适用性。
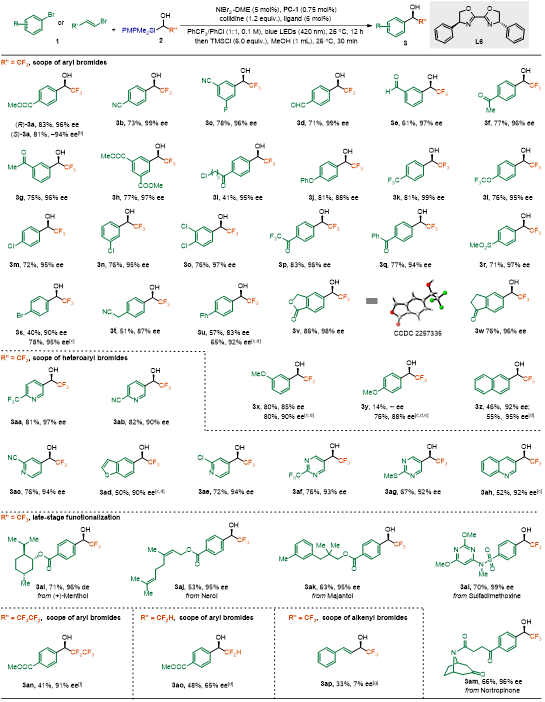
图3. 底物拓展(来源:Angew. Chem.)
作者对反应机理进行了较详细的实验研究。通过分离硅醚中间体3a'(71%收率,95% ee)和TEMPO自由基捕获实验表明该反应经历了自由基Brook重排的过程(图4a,b)。为探究Ni(II)中间体5a是否为关键中间体,文章进行了一系列对照实验图(4c-f),实验结果提示Ni(I)/Ni(III)催化循环可能比Ni(0)/Ni(II)循环更占优势。荧光淬灭实验显示芳基溴化合物1a和Ni(II)催化剂均不能淬灭PC-1,但硅醇底物2g,2g+collidine表现出显著淬灭效应,这与通过多位点质子耦合电子转移(MS-PCET)生成烷氧自由基中间体的过程一致(图4g)。基于此,对该反应提出了可能的反应机理:首先,光激发光敏剂PC-1生成激发态PC-1*,随后将底物硅醇化合物2g氧化,生成芳基自由基阳离子中间体I;接着,中间体I通过多位点质子耦合电子转移(MS-PCET)以及1,2-Brook重排形成烷基自由基中间体III。自由基中间体III被Ni(0)物种捕获从而形成Ni(I)中间体IV;之后Ni(I)物种IV与另一底物芳基溴化合物发生氧化加成得到Ni(III)中间体V;最后,Ni(III)物种V发生还原消除释放产物3'和Ni(I)Br物种VI。Ni(I)Br物种VI可以被PC-1自由基阴离子还原,再生成Ni(0)物种并继续参与下一催化循环。此外,为了阐明对映选择性来源,作者借助理论计算分析了还原消除步的过渡态。计算结果表明,过渡态(R)-TS-1的活化能垒比(S)-TS-1低3.2 kcal/mol,与实验观察到的对映选择性一致。进一步的非共价相互作用(NCI)分析表明,有利的过渡态(R)-TS-1存在更多的弱相互作用(图4i)。
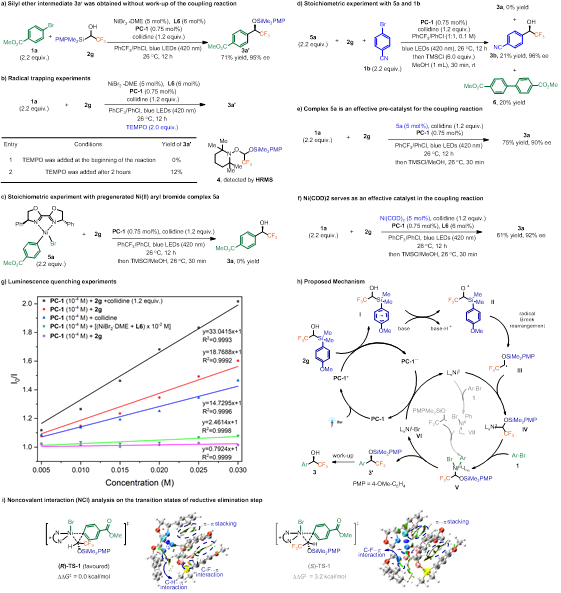
图4. 机理实验(来源:Angew. Chem.)
该方法的通过放大量实验合成药物中间体3s(0.9 g,71%收率,96% ee)(图5a)。3s可进一步转化为多功能手性烷基化试剂7,用于构建C-N、C-C、C-O和C-S键(图5b)。此外,手性二芳基甲烷(如10a–10d)的合成展示了该策略在药物化学中的潜力(图5c)。
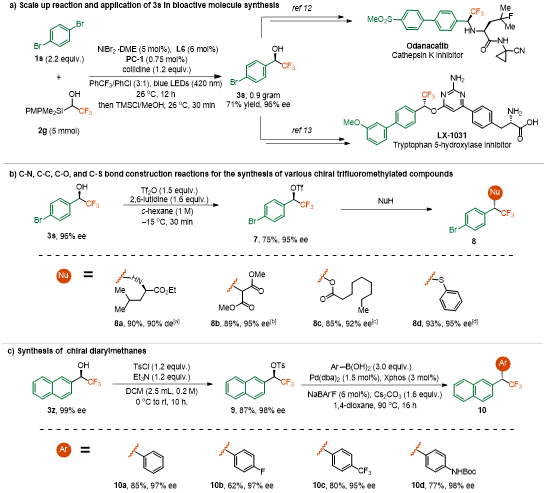
图5. 合成应用(来源:Angew. Chem.)
在该工作中,沈晓团队开发了一种基于自由基Brook重排策略,通过光镍协同催化,实现α-氟烷基醇的立体汇聚式合成。这一转化的关键在于自由基接力过程,即通过初始生成的芳基自由基阳离子高效转化为碳自由基。该方法具有优异的底物适用性,并已成功应用于药物相关化合物(如Odanacatib和LX-1031)的形式合成及多种下游衍生化反应,充分展现了其显著的合成实用性。值得注意的是,本研究首次将自由基Brook重排应用于催化不对称交叉偶联反应中。这一策略将为探索Brook重排在不对称催化中的应用开辟新途径,并推动自由基介导的对映选择性转化的进一步发展。




