【Green Chem.】兰州大学许鹏飞教授: 2-甲基-2-(吡啶-2-基)丙二腈:用于光催化氰化反应的位点选择性氰基转移试剂

腈类化合物是天然产物和药物分子中重要的结构单元。例如结构复杂的吲哚生物碱Lahadinines A,以及含有腈类骨架的药物分子如维格列汀、利匹韦林和氰戊菊酯等(图 1a)均凸显了其重要性。此外,在有机合成中氰基可作为一种通用的前体,用于合成醛、胺、羧酸、酰胺及氮杂环化合物。这优势的存在促进了在复杂分子骨架中实现位点选择性引入氰基的方法学的发展。一直以来人们在新氰化试剂的开发中持续付出了许多努力。传统氰化试剂主要利用氰基离子的亲核性,包括氢氰酸、金属氰化物(如NaCN、CuCN)、三甲基硅氰以及近期开发的二苯基磷氰(图 1b),这些试剂在经典的人名反应Kolbe nitrile synthesis和Sandmeyer reaction中得到了很好的应用。然而,此类方法因产生化学计量的重金属废物及导致催化剂失活而存在显著局限性。
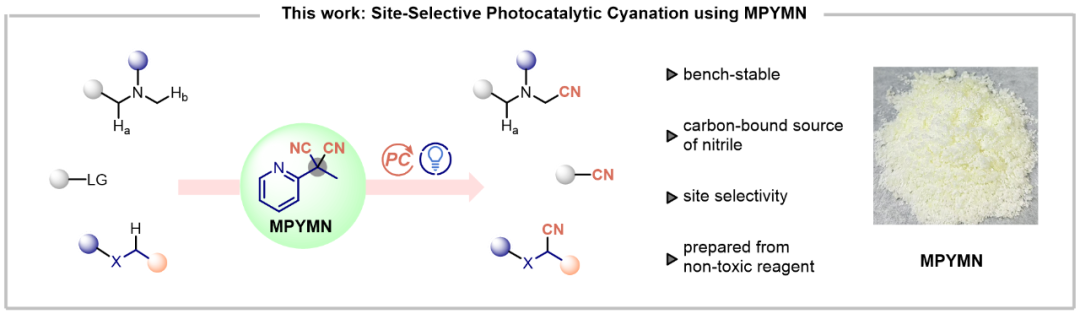
图1:研究背景(图片来源:Green Chem.)
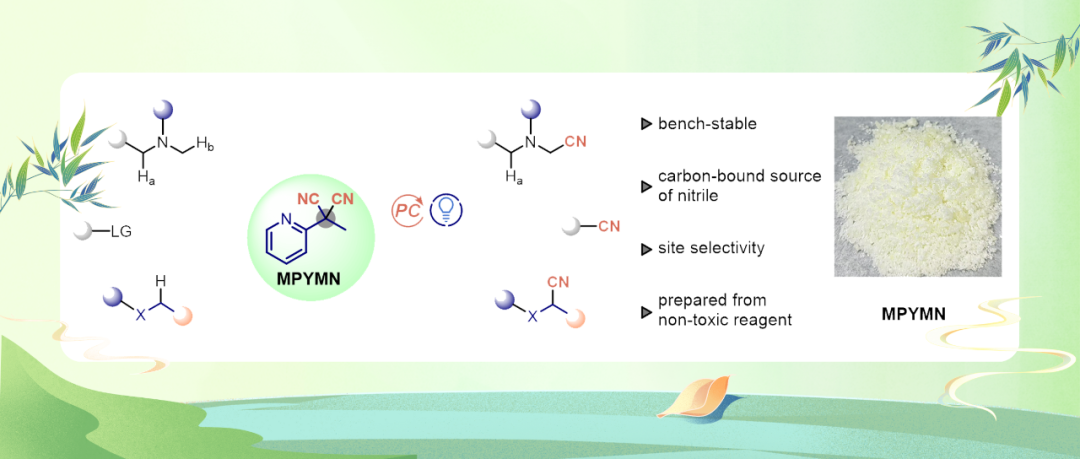
近日,兰州大学许鹏飞课题组报道了一种碳键自由基氰化试剂——2-甲基-2-(吡啶-2-基)丙二腈(MPYMN),该试剂可在无金属光催化条件下实现高反应活性和位点选择性的氰化反应。该试剂通过在丙二腈骨架中策略性引入吸电子吡啶基团,不仅激活了C-CN键,同时稳定了产生的碳中心自由基。更为关键的是,苄位季碳中心的空间位阻能够选择性地捕获底物不同反应位点中空间位阻较小的碳自由基。MPYMN以2-吡啶乙腈和二甲基丙二腈为原料,通过一锅法合成,产率达63%(10克规模),并具有较好的热稳定性和碱稳定性。
随后作者评估了MPYMN在具有挑战性的胺类化合物位点选择性氰化反应中的反应性能。以N-甲基二丁胺(1a)为模型底物进行系统优化表明:在乙腈溶剂中,使用5 mol% 4CzIPN作为光催化剂,于25℃、460 nm LED光照下反应24小时,可获得92%收率的氰基化产物3a(15:1 r.r.),同时生成等当量的副产物4(表1,条目1)。氰化反应优先发生在甲基位点而非取代度更高的亚甲基位点,证实了MPYMN的空间位阻效应可引导区域选择性朝向位阻较小的位置。与其他C-CN键氰化试剂的对比研究表明,MPYMN具有较高的应用潜力。值得注意的是,MPYMN在反应活性和选择性方面均优于商品化氰化试剂。对照试验表明光照和光催化剂都是不可缺少的反应条件。
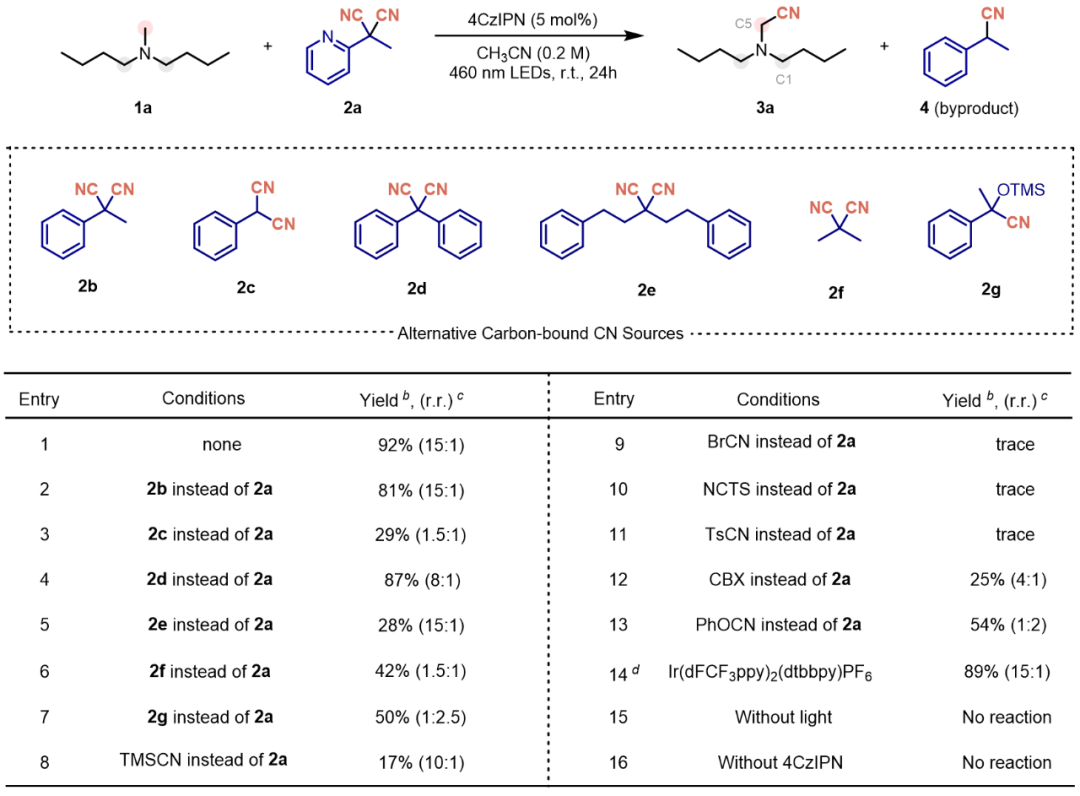
表1:光催化氰化反应条件的优化(图片来源:Green Chem.)
在获得优化反应条件后,本文系统考察了该C-H氰化反应对不同胺类底物的适用范围(图2a)。首先考察了含多个反应位点的胺类底物。与标准反应结果一致,甲基位点反应活性始终优于亚甲基位点,即使当氮原子相邻存在两个不同亚甲基时亦然。该反应对多种官能团(例如烯基,卤素等)都具有良好的耐受性。此外对分子中含有CH₃/CH以及CH₂/CH₃的不同位点选择性氰基化的底物进行了拓展,结果也表明了小位阻位点的选择性。
含氰基药效团在临床治疗中的广泛应用,凸显了氰基作为生物电子等排体和代谢稳定性增强基团的关键作用。为验证本方法的合成实用性,本文对多个药物相关骨架进行了后期氰化反应(图2b),包括禾草碱、多奈哌齐、丙米嗪、苯海拉明和利多卡因衍生物。令人满意的是,这些具有药物优势的骨架在标准条件下均能顺利发生氰化反应,以具有合成应用价值的收率(52%-98%)和专一位点选择性(>20:1)得到产物。
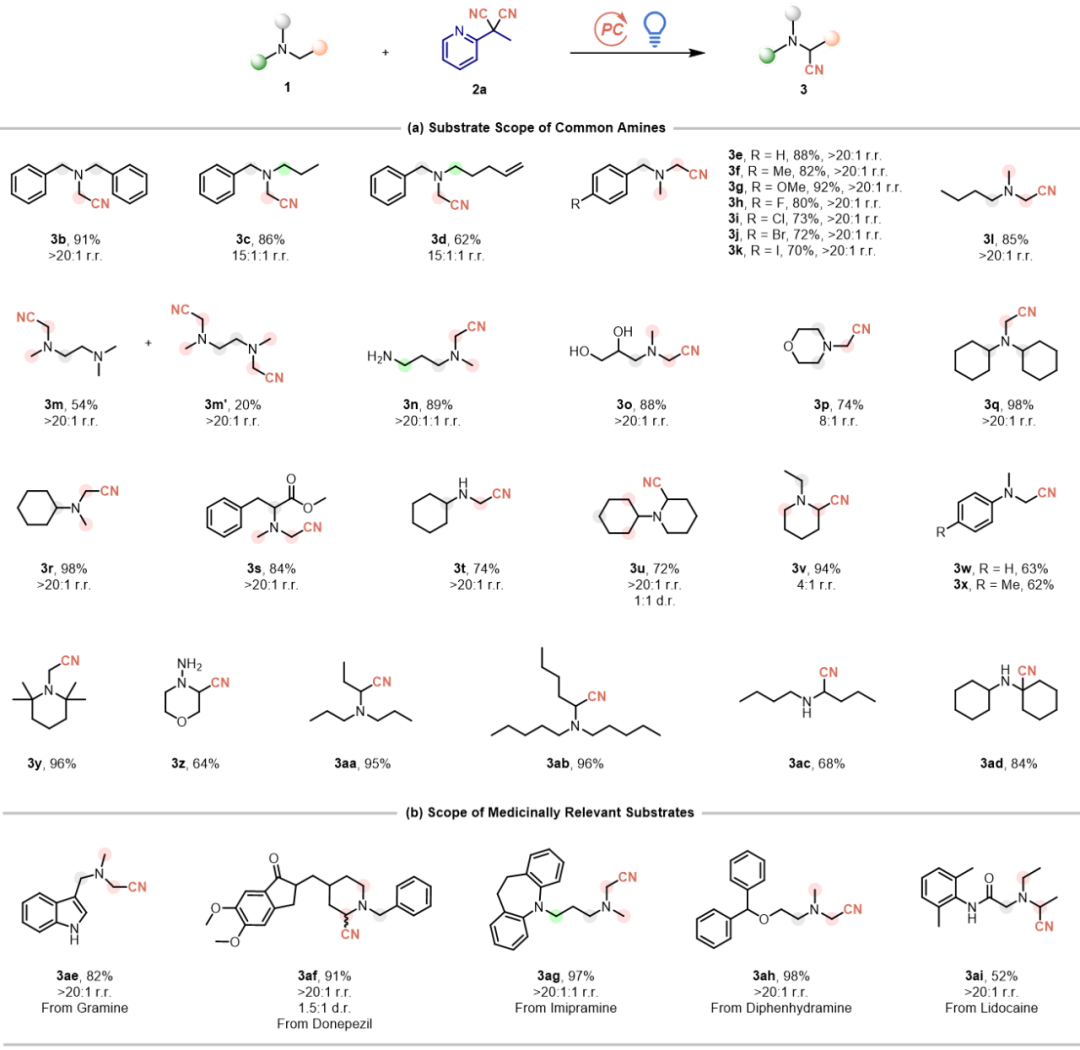
图2:普通胺类化合物的底物拓展和药物分子的底物拓展(图片来源:Green Chem.)
除了电子转移策略,作者采用十钨酸盐介导的氢原子转移(HAT)策略,在温和条件下实现了C-H氰化反应(图3a)。以N-Boc-吡咯烷为模型底物进行初步优化研究,确定TBADT(1.5 mol%)/乙腈(0.17 M)为最优催化体系,以91%的分离收率获得N-近端氰基取代产物6a(表S4)。在此条件下进行的底物范围考察表明该方法除了在N, O, S等杂原子的α位氰基化反应中取得较好的收率,还可以在苄位以及普通烷烃的C-H氰基化反应中具有广泛适用性。此外,氰化过程对简单烷烃中位阻较小的甲基位点保持区域选择性,且该选择性在二次氰化反应中依然存在。
MPYMN还可以应用于预官能团化的自由基前体,实现多样化的氰化转化反应(图3b)。以MPYMN作为氰化试剂,实现了氨基酸7的可见光驱动光催化脱羧氰化反应,以87%的收率获得氰化产物。随后,在相同条件下以三氟硼酸盐9作为自由基前体,以90%的收率得到α-氨基腈。尽管这两类转化反应均需使用化学计量的过量2a,但未反应的2a在该条件下展现出优异的可回收性,可显著减少试剂浪费并提升方案的原子经济性。
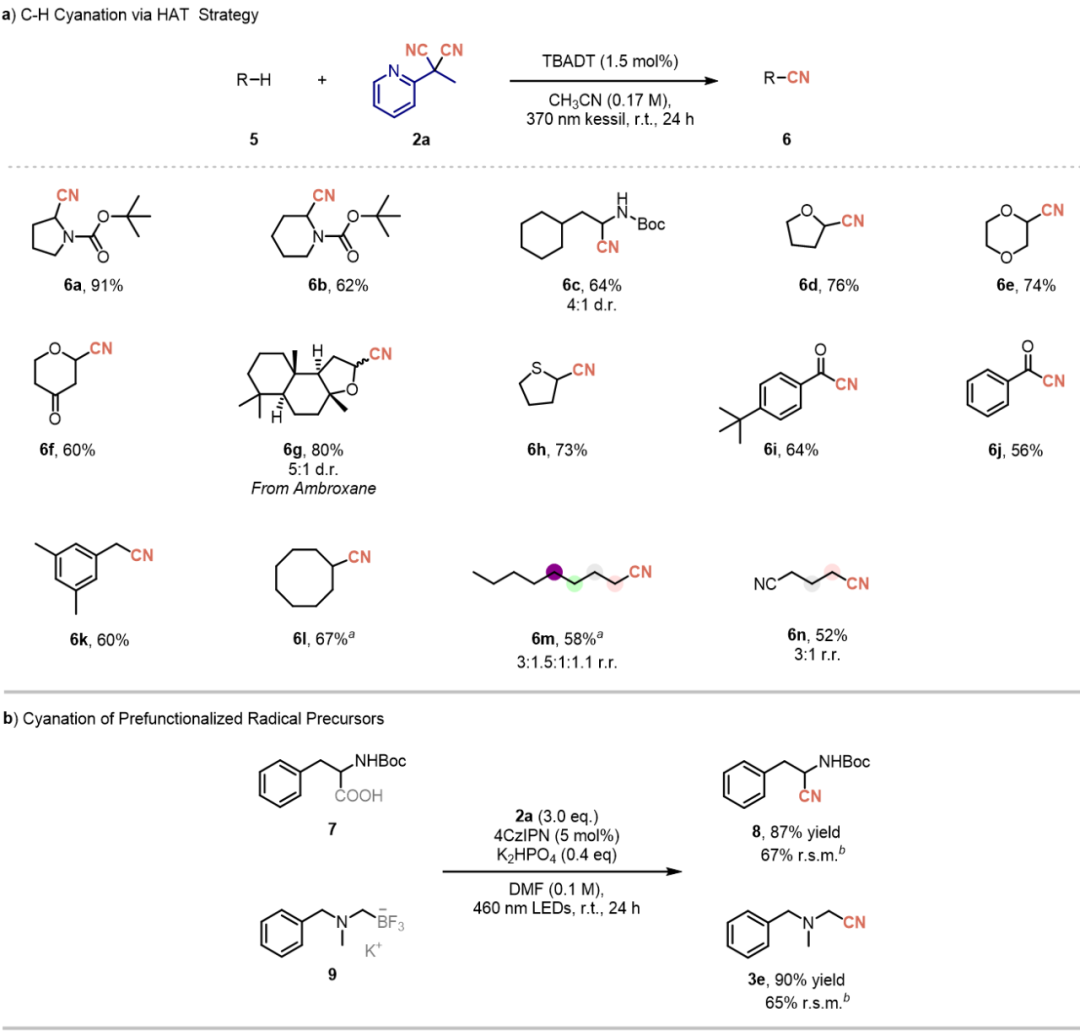
图3:HAT策略的底物拓展和预官能团化底物氰基化(图片来源:Green Chem.)
为验证MPYMN试剂在光催化氰化反应中的合成实用性,作者进行了克级规模反应,以84%的收率获得产物3e(图4)。在合成化学中,引入氰基作为关键中间体能够高效构建目标分子。将氰化产物3e进行酸性水解反应,可得到α-氨基酸10;通过LiAlH₄还原氰基获得二胺11;其与2-氨基苯硫酚12反应则生成含氮杂环化合物13(噻唑衍生物)。这些转化反应充分展现了MPYMN在有机合成中的多功能性与合成潜力。
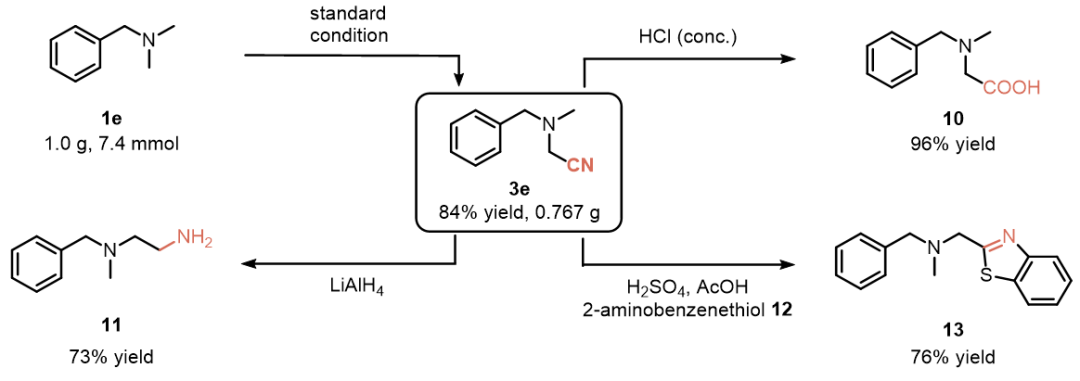
图4:克级反应和氰基化产物的衍生化(图片来源:Green Chem.)
为深入探究反应机理,作者开展了一系列机理验证实验。首先,TEMPO捕获实验(图5a)和自由基钟实验(图5b)证明了反应发生的自由基路径。荧光淬灭实验表明仅有胺类底物可淬灭光催化剂的激发态,提示反应遵循氧化淬灭机制(图5c)。此外,氘代实验结果表明副产物4中的氢原子主要来源于后处理过程中的外源水及胺类底物。最后,计算所得的量子产率(Φ = 0.0049)及光开关实验排除了链式反应机制的可能性(图5e)。
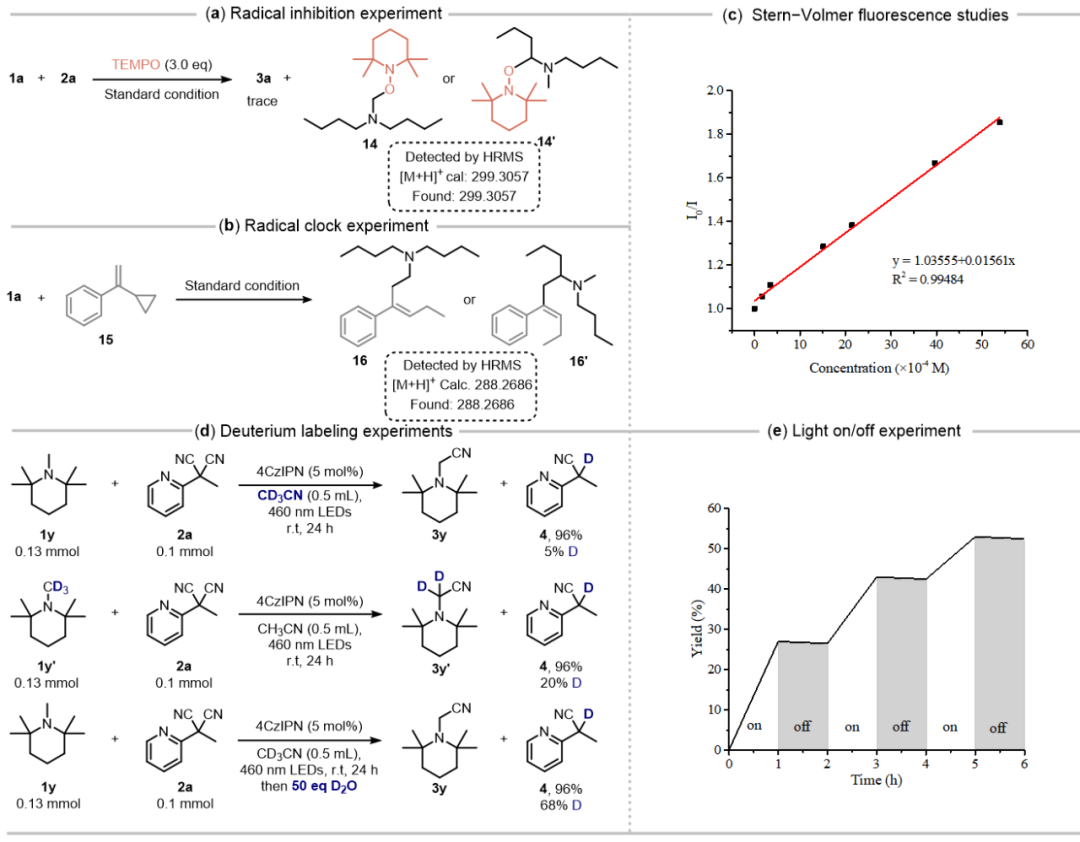
图5:机理验证(图片来源:Green Chem.)
根据实验结果及已有机理研究,作者提出了胺类化合物位点选择性α-氰化反应的合理机理(图6)。在蓝光照射下,激发的有机光催化剂4CzIPN*氧化底物1a,后者经去质子化生成α-氨基烷基自由基Ia和Ib,该自由基生成过程可被视为非选择性。这些自由基对氰化试剂2a中缺电子的氰基进行亲核加成,形成亚胺自由基中间体II。该自由基加成过程受空间位阻调控而呈现位点选择性,当使用MPYMN时,空间位阻较小的自由基优先发生氰化反应,其他位点反应则被抑制。随后中间体IIa发生β-碳断裂,生成产物3a和自由基III。III与4CzIPN•⁻发生单电子转移(SET),使催化剂恢复至基态4CzIPN,完成催化循环。最后中间体IV经质子化生成副产物4。
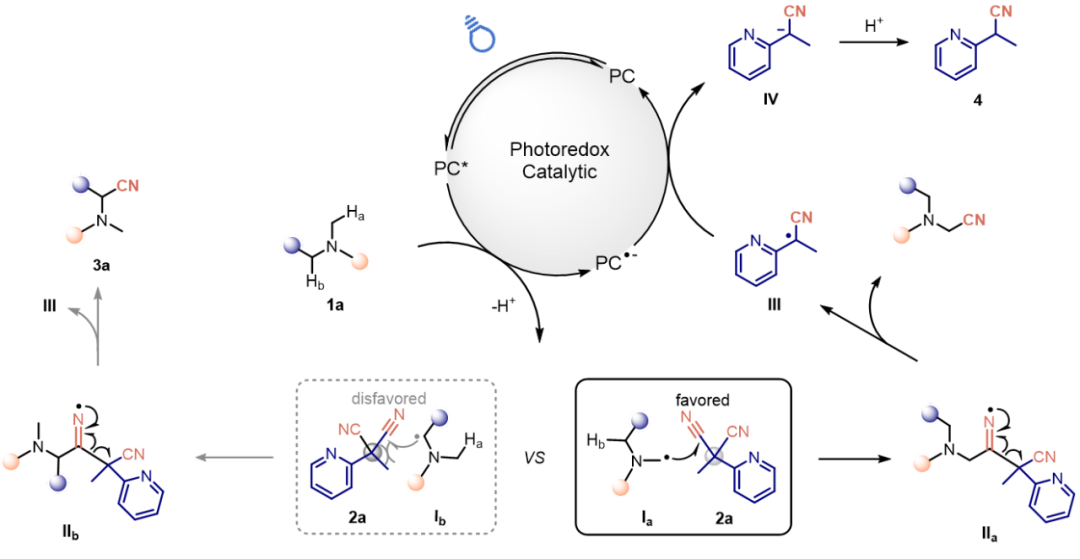
图6:反应机理(图片来源:Green Chem.)
总之,作者开发了2-甲基-2-(吡啶-2-基)丙二腈(MPYMN)——一种常温稳定、高效碳键氰化试剂。该试剂能够在无金属光催化条件下实现具有卓越反应活性和位点选择性的氰化反应。除了通过光氧化还原和氢原子转移(HAT)途径实现对多种底物的C-H氰化外,MPYMN还能完成复杂预官能团化分子的氰基功能化。性能对比研究表明,MPYMN的表现优于商品化氰化试剂及其他碳键氰源。这一策略从根本上消除了有毒氰源和过渡金属的使用,显著降低了反应体系的毒性与环境风险,为绿色化学提供了一种实用且具有范式转变意义的新方法。
该篇工作通讯作者为兰州大学的许鹏飞教授,博士研究生谭相闯为该论文的第一作者。相关研究成果发表于Green Chem.(DOI:DOI: 10.1039/d5gc03425f)。研究工作得到了国家自然科学基金(U22A20390)、甘肃省科技重大专项(22ZD6FA006、23ZDFA015、23JRRA1512)的支持。
论文信息:
通讯作者:许鹏飞教授
作者:谭相闯、闫磊、秦浩妮
论文名称:2-Methyl-2-(pyridin-2-yl)malononitrile: a site-selective cyano transfer reagent for photocatalytic cyanation reactions
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




