【Angew. Chem.】川大曹伟地/冯小明:可见光介导手性Lewis酸催化缺电子烯烃的不对称硅氢化/硅锗化反应

第一作者:陈晓帆
通讯作者:曹伟地、冯小明
通讯单位:四川大学化学学院
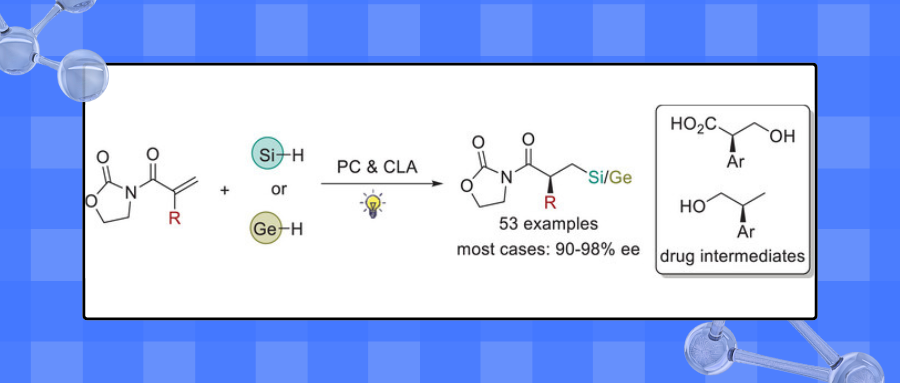
四川大学曹伟地教授/冯小明教授团队通过使用光催化剂和手性Lewis酸协同催化策略完成了缺电子烯烃的对映选择性硅氢化和锗氢化反应(53 examples)。其中,9,10-蒽醌作为氢原子转移(HAT)光催化剂促进Si-H/Ge-H键断裂生成硅/锗自由基,同时与底物烯烃之间存在π-π相互作用调节对映选择性。手性双氮氧/ Zn(Ⅱ)配合物(冯催化剂)作为Lewis酸,活化烯烃并提供优异的手性环境。该反应对映选择性高,适用于多类硅烷和锗烷化合物。所得手性有机硅化合物通过简单转化可生成手性托品酸及其衍生物等药物中间体。基于光谱实验、动力学实验、氘代实验以及理论计算,提出了可能的反应机理。
(1) 过渡金属催化烯烃不对称硅氢化反应的现状和挑战
手性有机硅化合物广泛应用于合成化学、医药研发、农用化学品及功能材料等领域,过渡金属催化烯烃的不对称硅氢化反应是合成该类化合物最重要的方法之一(图1a),发展比较成熟,但仍存在一些局限:
硅烷与催化剂的适配性:硅烷取代基的电子和位阻效应对其活性影响很大,导致同种催化剂很难适用于不同种类的硅烷,尤其是三烷基取代硅烷与烯烃的不对称硅氢化反应,目前报道很少,且取代基效应也导致反应存在区域选择性。
烯烃底物的局限性:过渡金属催化烯烃的不对称硅氢化反应主要适用于富电子烯烃,对于缺点子烯烃,尤其是α,β-不饱和羰基化合物,通常得到烯烃或羰基还原的副产物。目前该领域仅限于环状缺电子烯烃一例报道(Nat. Commun. 2020, 11, 2904)。
(2) 光催化烯烃不对称硅氢化反应的现状和挑战
光化学的兴起为烯烃的硅氢化反应提供了新平台。在光照条件下,基于硅自由基的烯烃硅氢化反应适用于Si-H,Si-B,Si-Si等多类有机硅化合物以及富/缺电子烯烃,区域专一性得到反马氏加成产物(图1b,左)。但由于反应涉及高活性的自由基中间体,立体选择性控制是一个很大挑战。目前,已报道的例子仅限于利用手性硫醇催化富电子环外烯烃的不对称硅氘化反应(图1b,右)(Nat. Commun. 2022, 13, 4453; Org. Chem. Front. 2023, 10, 1182)。
(3)光催化剂与手性Lewis酸协同催化缺电子烯烃的不对称硅氢化和锗氢化反应
针对上述科学问题,作者发展了光催化剂与手性Lewis酸协同催化体系,基于自由基历程,实现了α,β-不饱和酰胺的不对称硅氢化和锗氢化反应,构建了一系列反马氏加成的手性有机硅和有机锗化合物。产物进一步衍生得到多种药物分子(图1c)。
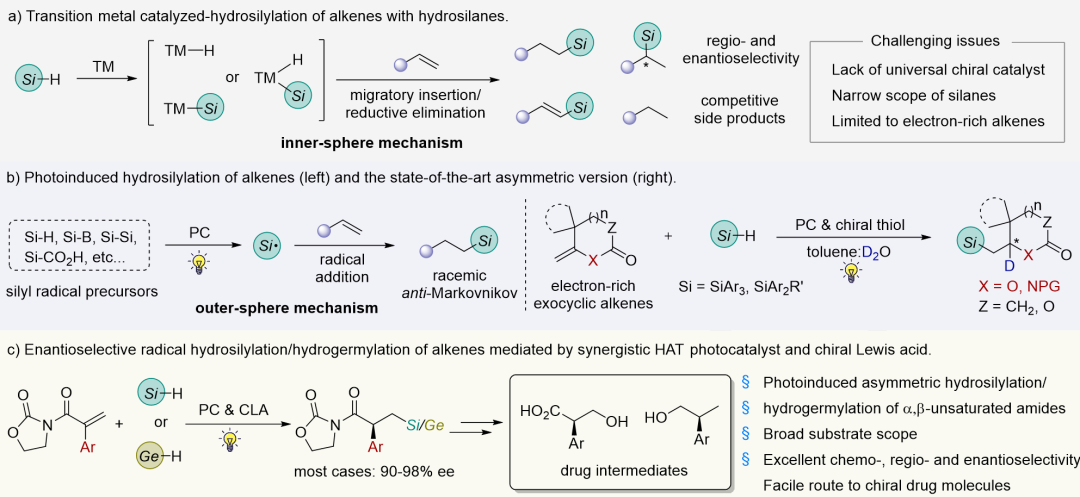
图1. 过渡金属催化硅氢化反应和光/Lewis酸协同策略的硅氢化和锗氢化反应(来源:Angew. Chem. Int. Ed.)
本文亮点
(1) 首例光催化缺电子烯烃的不对称硅/锗氢化反应。
(2) 催化剂价廉易得,底物普适性好,化学、区域和立体选择性高。
(3) 为手性托品酸及其衍生物等药物分子的合成提供了高效新途径。
条件优化:
以苯乙酸衍生的烯烃A1和二甲基苯基硅烷B1作为模板底物,对反应条件进行优化。通过考察光源、光催化剂、温度、金属盐、配体和底物比例等,确定了最优反应条件:9,10-蒽醌(AQ,10 mol%)和Zn(OTf)2/L3-PrtBu(冯催化剂)(10 mol%)为协同催化剂,乙腈为溶剂,在-30℃和5 W,420 nm,光照条件下反应,以83% 收率和98% ee得到目标产物C1。其中传统金属类光催化剂(如Ru/Ir配合物)及二苯甲酮类光催化剂(TXO、XO和FLN)均未能有效催化该反应。而结构相似的醌类光催化剂PQ能以44%收率和96% ee得到目标产物(图2)。
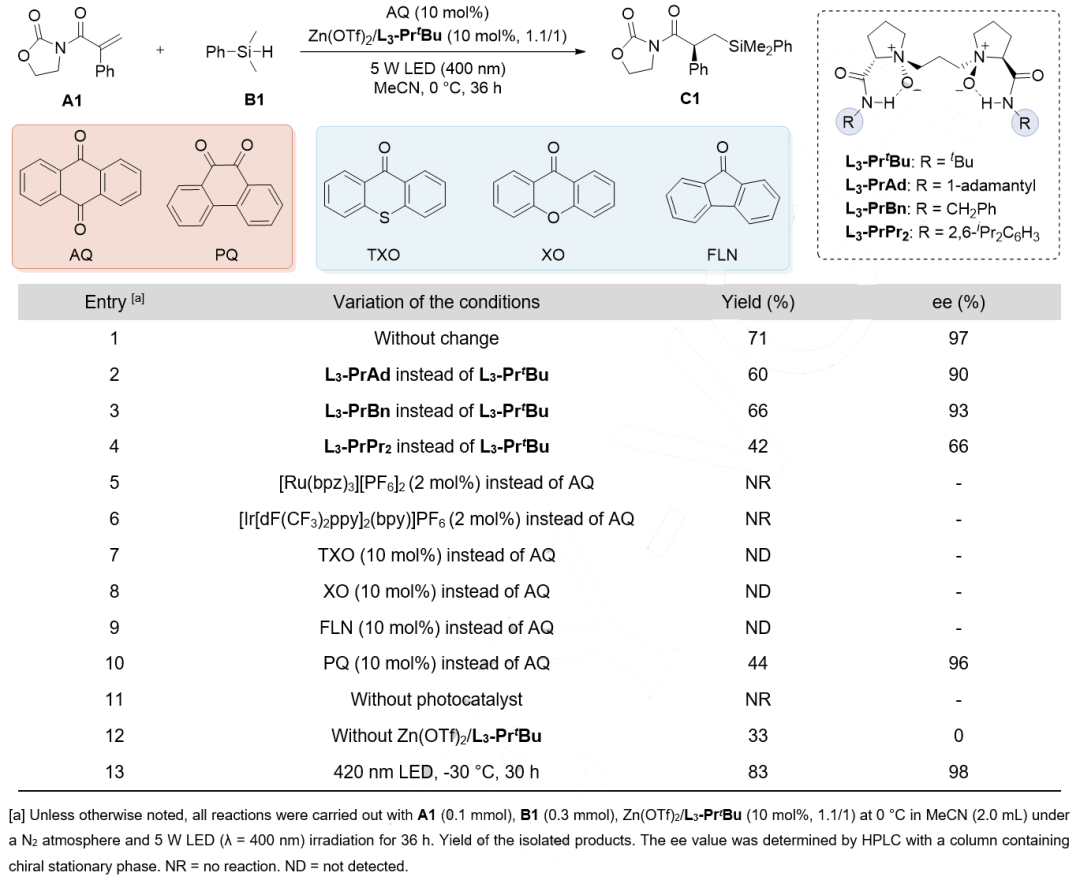
图2. 条件优化(来源:Angew. Chem. Int. Ed.)
底物扩展:
(1)硅氢化反应
首先对硅氢化反应的底物范围进行了考察(图3)。在最优反应下,各种二甲基芳基硅烷(C1-C8)都能以较好的结果得到目标产物(65-83% yield,95-98% ee),C7收率(16% yield,98% ee)较差的原因可能是Si-H键键能较高,导致活性较低。苯环上二硅基取代的C8也能顺利得到产物(63% yield,92% ee)。单烷基二芳基硅烷或三芳基硅烷(C9-C11)也有不错的结果(66-77% yield,86-96% ee)。此外,各类三烷基硅烷(C12-C20)都能以中等到优秀的收率和高的对映选择性得到目标产物(56-82% yield, 92-98% ee)。二氢硅烷类底物(C21-C24)也能顺利参与反应(55-82% yield,91-98% ee)。在扩展烯烃时发现,α-苯基上不同取代的烯烃都表现出良好的反应活性,以中等到优秀的收率和优异的对映选择性转化为目标产物,其中吸电子取代基的结果稍优于给电子取代基产物(C25-C28 vs C29-C34)。在使用萘基取代的烯烃时,除了硅氢化产物(C35)外,还得到了烯烃不对称还原的产物(C35’)。更改Evans基团能以69% yield,90% ee的结果得到产物C36。如果将烯烃α-位芳基更换为甲基,反应活性和对映选择性明显降低,证明了蒽醌与烯烃π-π相互作用的重要性。
(2)锗氢化反应
除各类硅烷,该催化体系还适用于首例光催化烯烃的不对称锗氢化反应,高对映选择性得到手性锗化合物(图4)。相对来说,锗烷的反应活性高于硅烷,可能是由于Ge-H键键能低于Si-H键键能,更容易发生氢原子转移。
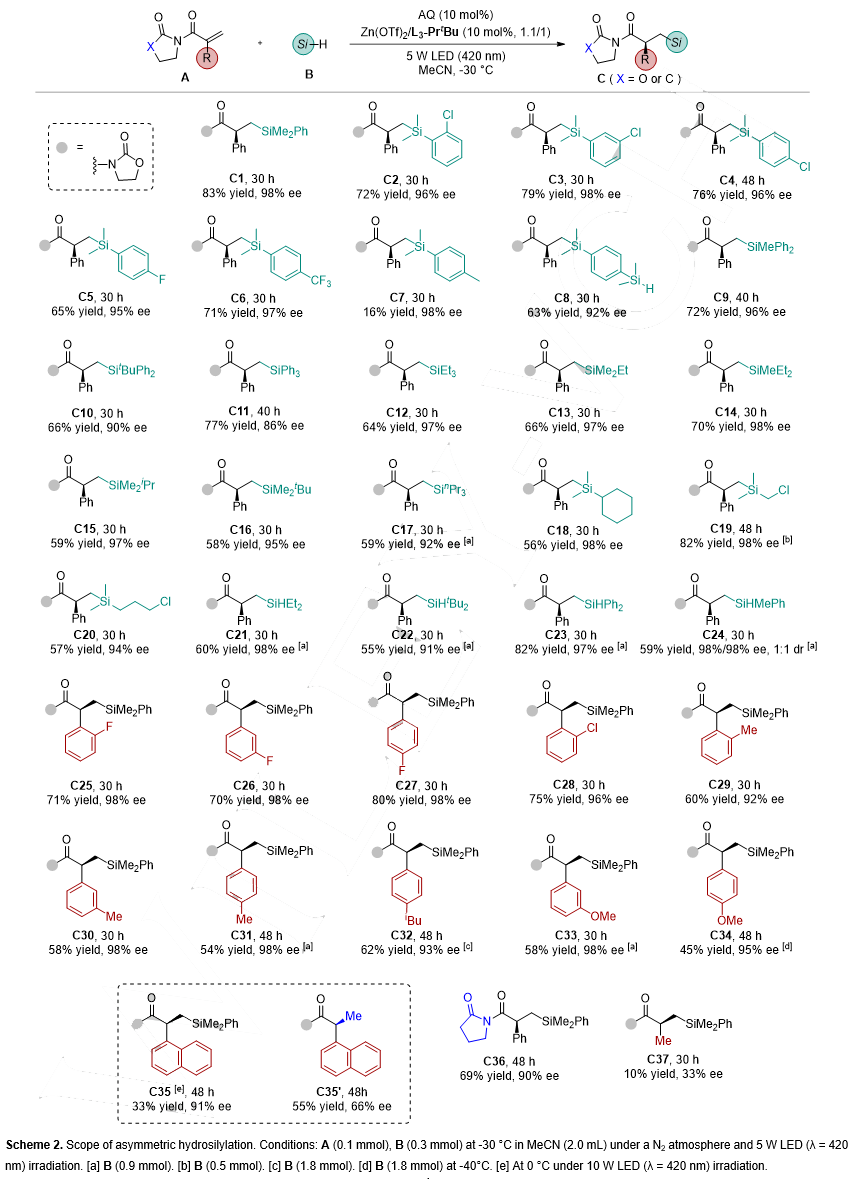
图3. 不对称硅氢化反应底物扩展(来源:Angew. Chem. Int. Ed.)
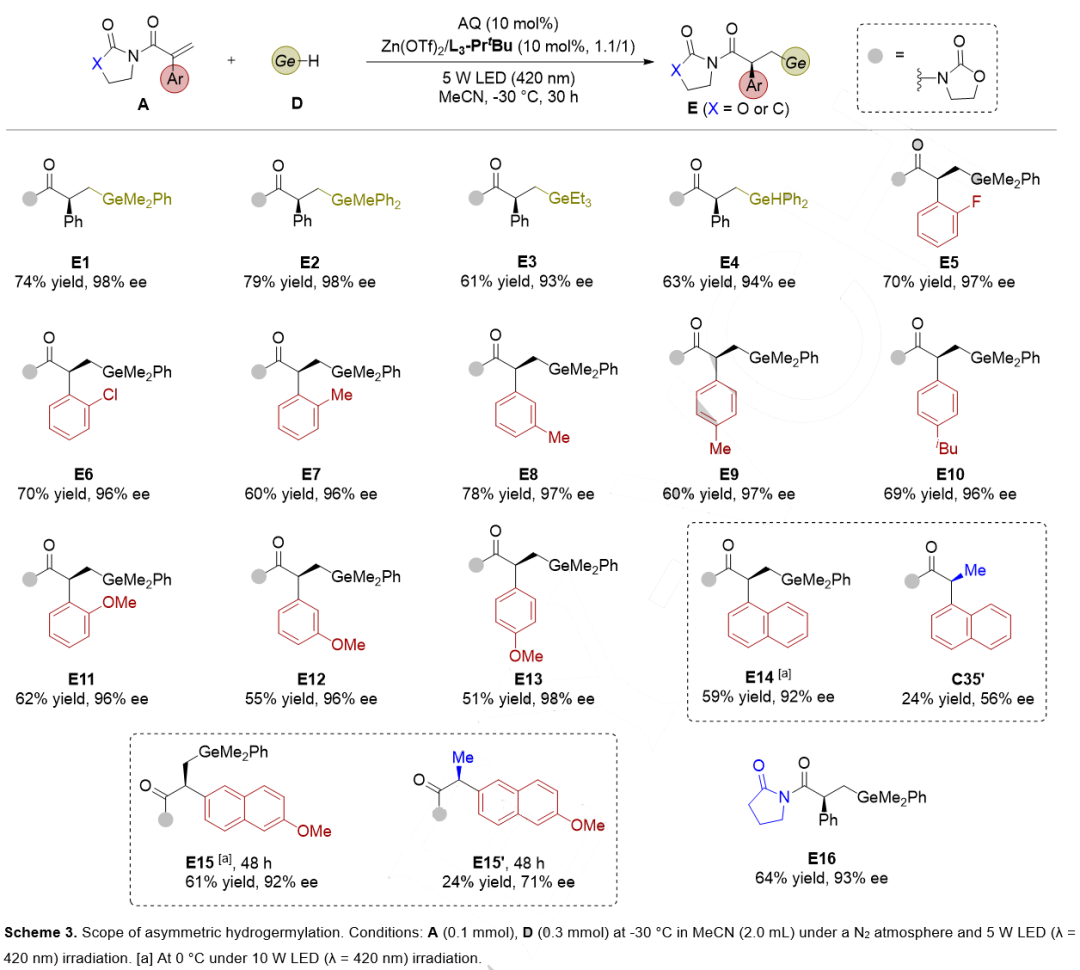
图4. 不对称锗氢化反应底物扩展(来源:Angew. Chem. Int. Ed.)
放大量实验和产物衍生:
首先进行了放大量实验(图5a),该体系能够在选择性保持的情况下实现克级规模放大(65% yield, 95% ee)。
随后进行了产物衍生实验,产物C1在Yb(OTf)3的催化下,与甲醇发生醇解得到F1,该中间体经LiAlH4还原得到1-羟基-3-硅基产物K1。F1也可以发生Fleming-Tamao氧化反应转化为β-羟基酸酯G1。经水解、酸化后得到手性托品酸。该中间体进一步转化可生成山莨菪碱、阿托品等药物分子。此外,中间体G1和G2还能通过还原反应得到I1和I2,进一步转化为生物活性分子或药物分子。
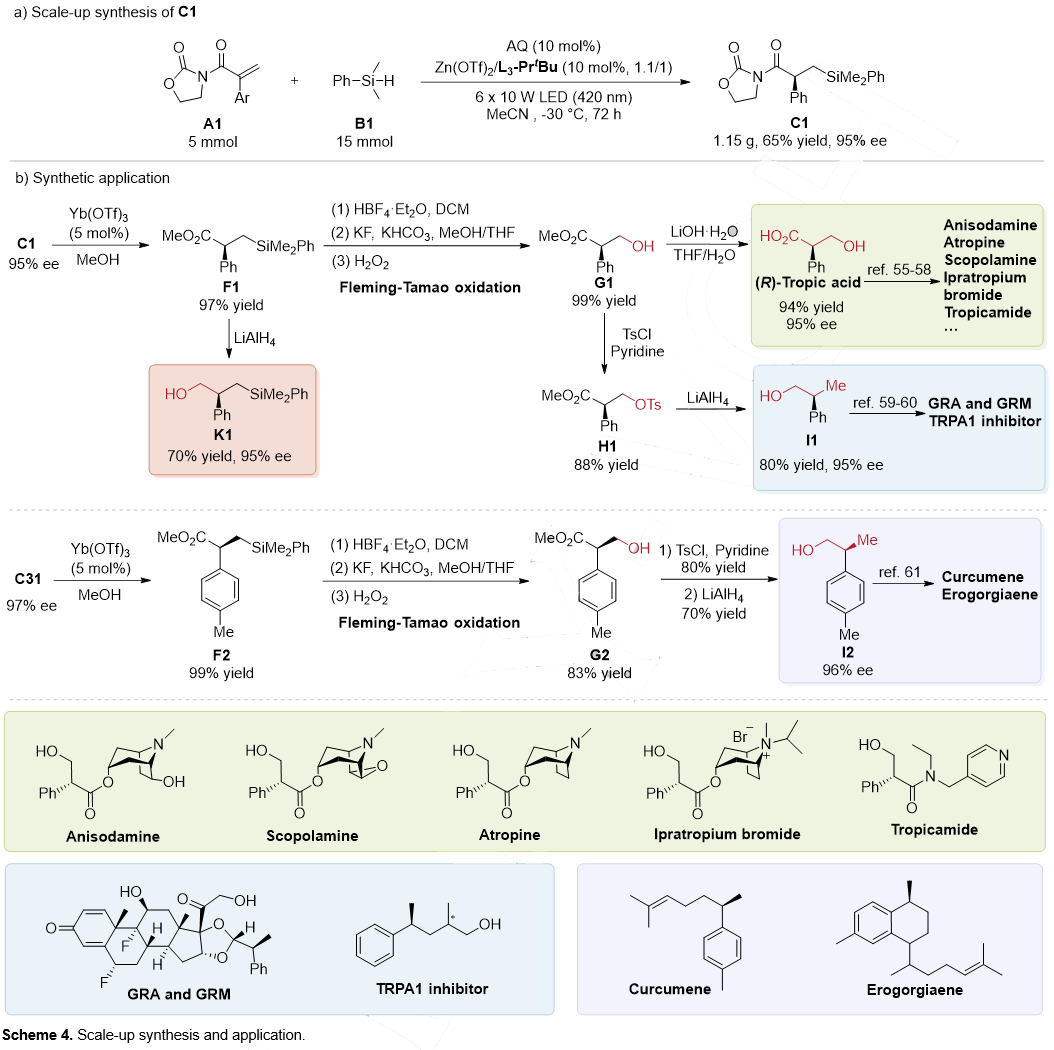
图5. 放大量实验和产物衍生(来源:Angew. Chem. Int. Ed.)
机理研究:
通过机理实验详细探究了反应历程(图6)。(a) 紫外-可见吸收光谱证实仅有蒽醌(AQ)在420 nm处具有特征吸收。(b) 荧光淬灭实验观察到烯烃(A1)与硅烷(B1)对激发态AQ的竞争性淬灭现象。(c) 自由基捕获实验证明了反应经历了自由基历程。(d) 无硅烷条件下仅能回收62%的A1,也证明了烯烃对AQ的淬灭作用。(e) 在氘代实验中,使用d-B1时产物氘代率仅16%,而添加D2O后氘代率显著提升且呈剂量依赖性,表明体系中存在的微量水参与反应。(f) 动力学实验结果表明,反应速率仅与AQ和B1浓度相关,与A1无关。除上述实验外,反应的量子产率实验为0.014,排除了链式反应机理。通过循环伏安法测得HSiMe2(p-CF3Ph)电势为 +2.37 V (vs. SCE),无法被激发态的蒽醌氧化(E(AQ*|AQ·¯) = +1.77 V),从而确定硅自由基的产生经历直接氢原子转移过程。
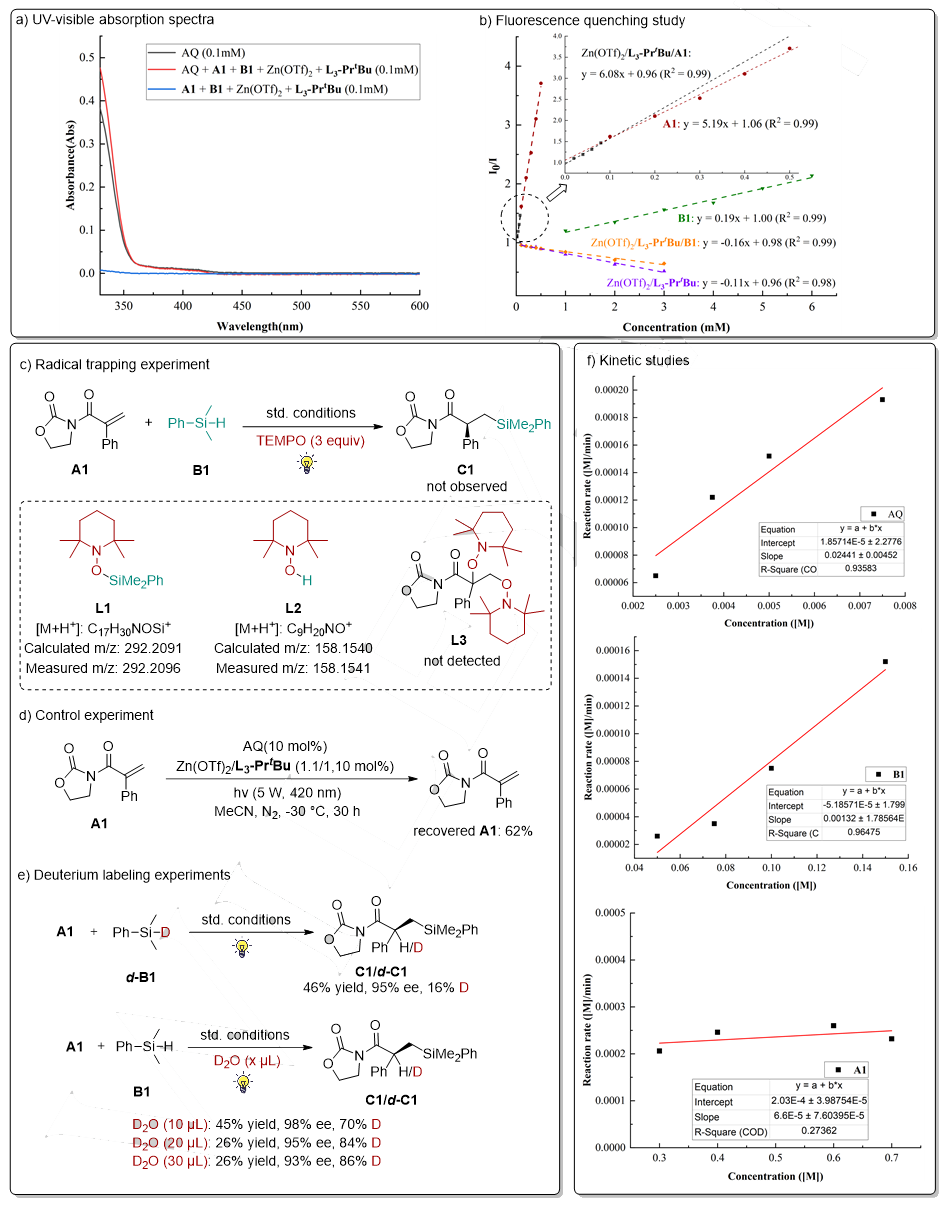
图6. 机理实验(来源:Angew. Chem. Int. Ed.)
理论计算研究进一步阐释了该催化反应过程(图7)。光照使基态蒽醌(AQ)首先跃迁至激发单重态(SAQ),随后通过系间窜越到达激发三重态(TAQ)。与硅烷发生氢原子转移(HAT),生成硅自由基和半醌自由基中间体(AQ-H·)。计算表明,经Lewis酸活化的烯烃底物(A1-[Zn]络合物)与硅自由基发生加成,形成关键的自由基中间体(DInt-3)。随后的转化过程涉及AQ-H·与Dint-3之间的单电子转移(SET),生成碳负离子中间体,并在水分子的作用下完成对映选择性控制的质子转移。弱相互作用分析证实了烯烃苯环与AQ之间的π-π相互作用,这种空间效应是反应的对映选择性控制的重要因素。
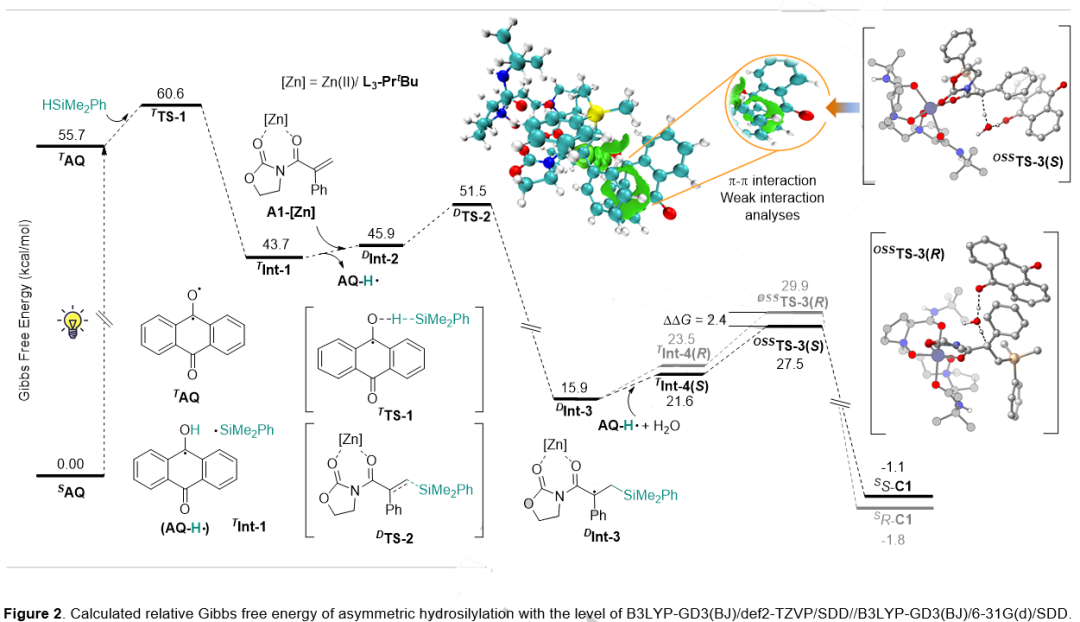
图7. 理论计算(来源:Angew. Chem. Int. Ed.)
该工作报道了光催化剂与手性Lewis酸协同催化缺电子烯烃的不对称硅氢化和锗氢化反应。这种可见光诱导的自由基反应底物普适性好,能够将各种硅烷和锗烷高效地转化为手性有机硅和有机锗化合物,并展现出优异的化学选择性、区域选择性和对映选择性,为相关药物和生物活性分子合成提供了重要的手性砌块。实验与理论计算阐明了反应机理。这种协同催化策略为缺电子烯烃的不对称氢官能团化反应提供了新方法,也为手性有机硅和有机锗化合物的合成和应用研究开辟了新途径。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




