摘要:近日,广州医科大学药学院曾中一联合易伟、高辉教授首次揭示光化学激活脱芳构化吡啶中间体的氧化还原活性,解锁吡啶间位磺酰化、胺基磺酰化及三氟甲基化等重要转化;该方法具有特异的区域选择性、优异的官能团兼容性及后期官能化等特点。
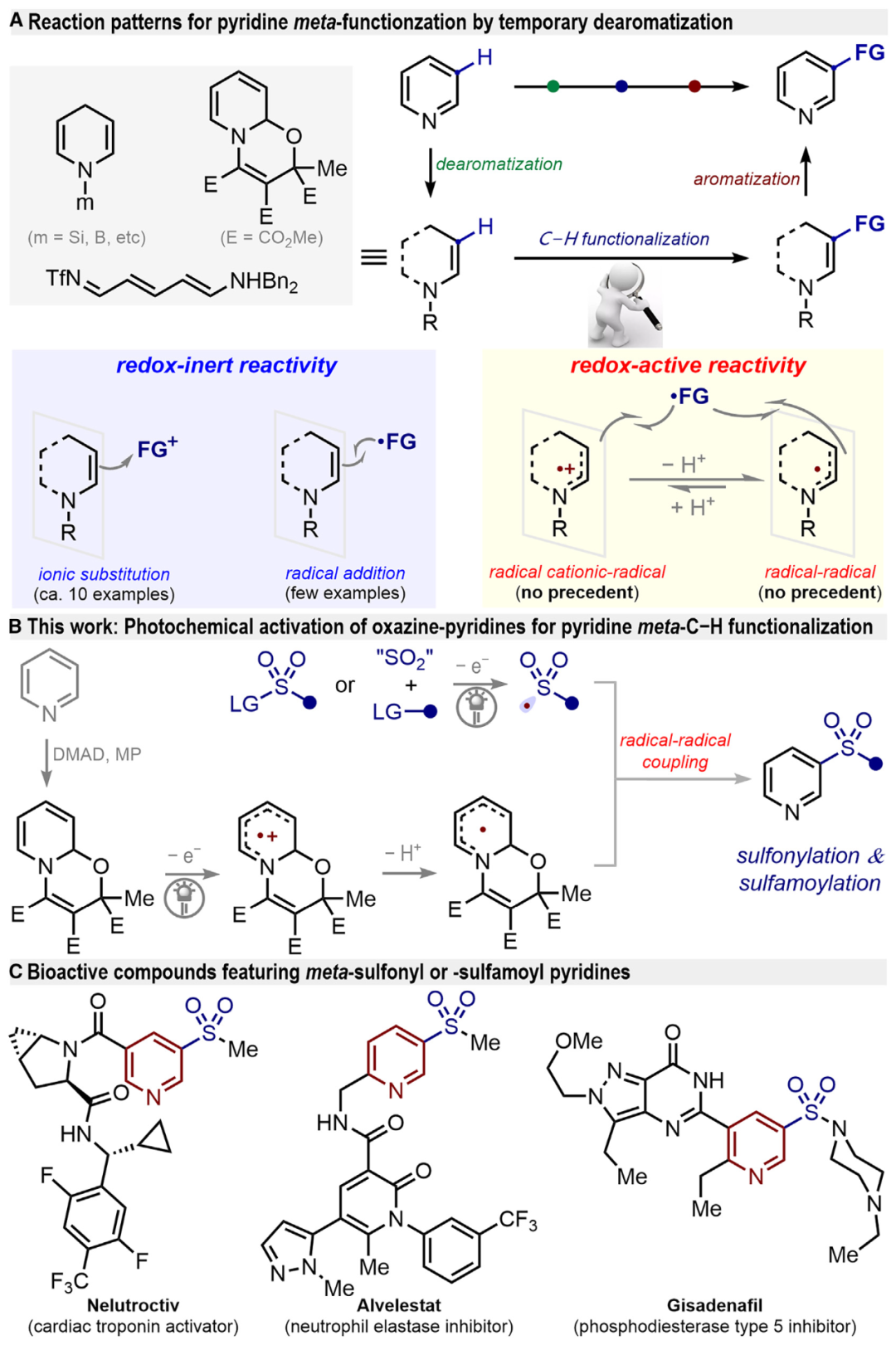
间位功能化吡啶作为一类高附加值的吡啶衍生物,在合成化学、药物化学、农业科学及功能材料等领域具有广泛的应用价值。从绿色合成理念出发,发展间位C−H键直接官能化策略被视为最为理想的方法。传统的亲电取代反应只能实现吡啶的间位硝基化和卤化,且存在条件苛刻(>200 °C)、收率低及区域选择性差等问题;发展的较温和方法依靠过渡金属催化的吡啶C−H键活化实现,但往往需要复杂配体设计和特定催化体系,且局限取代吡啶底物。为了解决这些问题,近期开发了临时脱芳化策略以实现吡啶间位功能化修饰;然而,现有方法均利用脱芳构化吡啶中间体作为氧化还原惰性的π-电子供体,进行离子型或自由基型亲电取代反应,这种单一反应模式导致新型转化模式的创新受限(图1)。
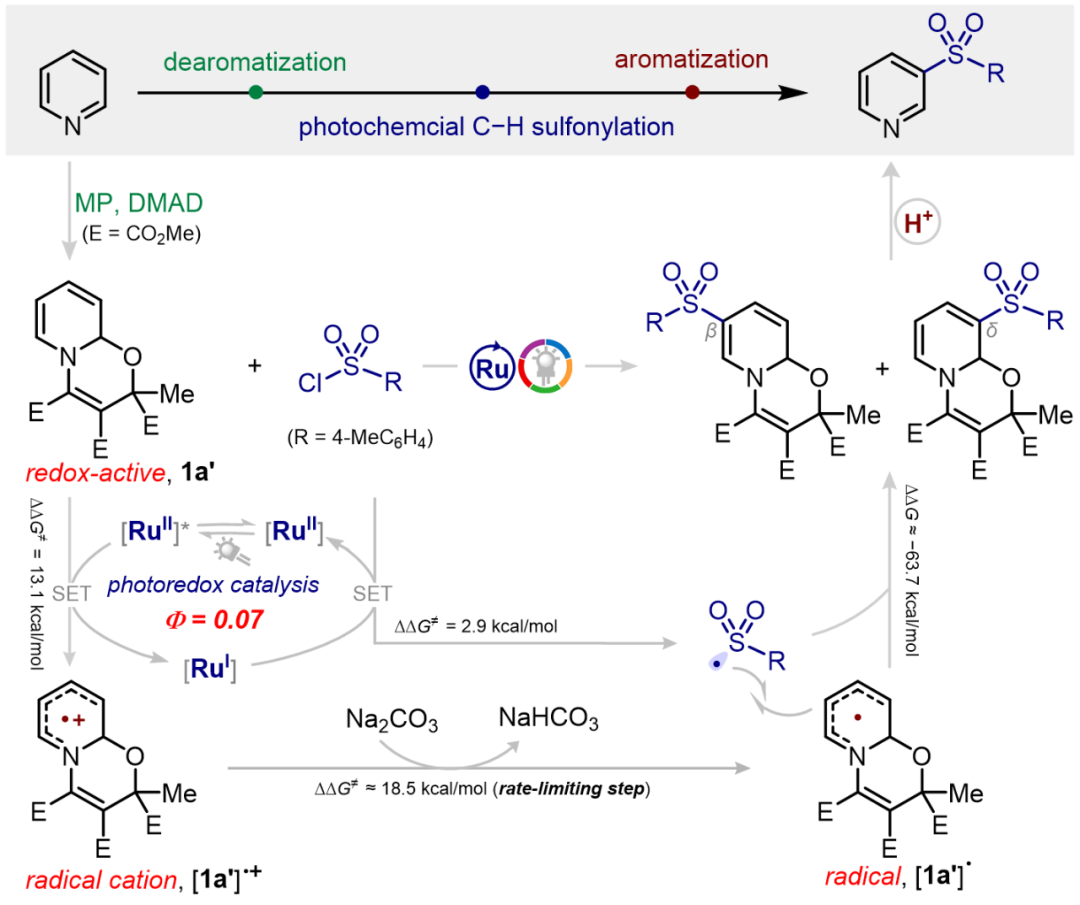
针对上述转化瓶颈,基于课题组前期在电化学吡啶间位修饰的工作积累(Nat. Commun. 2024, 15, 7428)。近日,广州医科大学药学院曾中一联合易伟、高辉教授首次揭示光化学激活脱芳构化吡啶中间体的氧化还原活性,解锁吡啶间位磺酰化、胺基磺酰化及三氟甲基化等重要转化;该方法具有特异的区域选择性、优异的官能团兼容性及后期官能化等特点。 图1. 临时脱芳构化驱动吡啶间位修饰及其意义(图片来源:Chem Catal.)起初,作者选取噁嗪并吡啶1a’与对甲苯磺酰氯(TsCl,2a)作为模板反应进行条件优化,偶然发现极少被研究、具有广谱吸收特性的cis-[Ru(bpy)2]Cl2·2H2O可以作为高效光敏剂;各种光源,包括紫光、绿光、黄光、模拟太阳光的氙灯及近红外光,均能驱动吡啶间位磺酰化。除了氯原子外,碘原子(2a-I)、溴原子(2a-Br)、氟原子(2a-F)、氰基(2a-CN)以及苯并三唑(2a-BT)也可作为离去基团,实现磺酰基的引入。
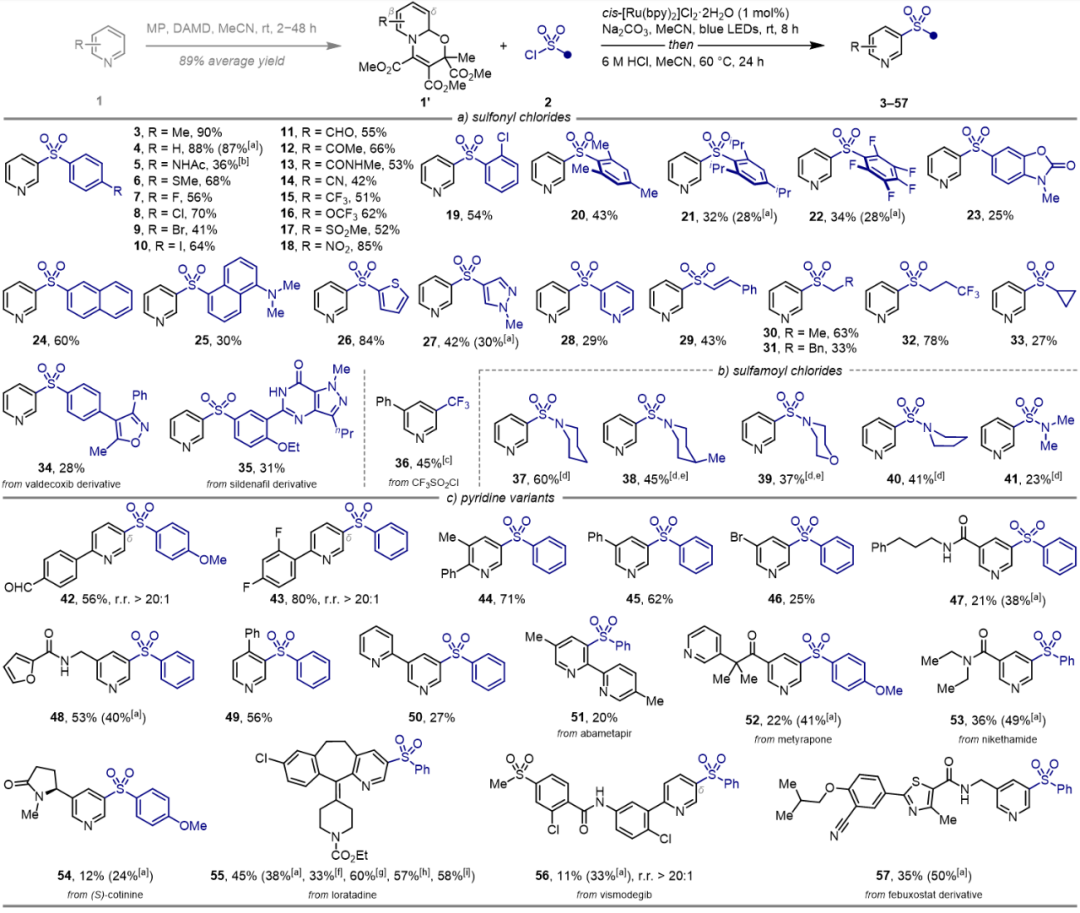
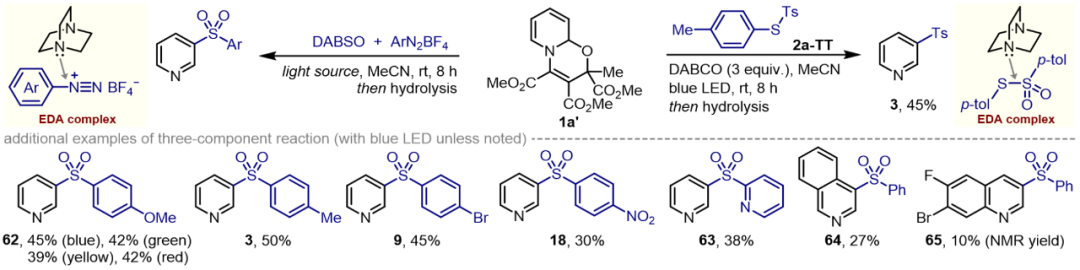
在最优光化学条件下,芳基、烯基甚至烷基磺酰氯都可以与吡啶进行选择性偶联,构筑结构多样的间磺化吡啶化合物库(图2)。反应能兼容多种常见官能团,包括氟、氯、溴、碘、酰胺、硫醚、甲酰基、酮基、氰基、三氟甲基、三氟甲氧基、磺酰基、硝基和氨基;也涵盖了空间位阻较大的取代基、五氟苯基、稠合芳烃以及噻吩、吡唑、吡啶等杂环芳烃。此外,三氟甲磺酰氯(CF3SO2Cl),可通过脱二氧化硫引入药学中极为重要的三氟甲基。需要特别指出的是,胺基磺酰氯由于其还原电位较低,通常需要硅烷激活;令人高兴的是,本方案也适用于胺基磺酰氯的直接活化,实现吡啶间位的胺基磺酰反应。不同电子效应基空间效应的吡啶前体都能进行间位选择性磺化,包括母体吡啶、单取代及二取代吡啶。该方法可以对吡啶药物分子进行后期官能化,如阿巴美帕尔(abametapir)、美替拉酮(metyrapone)、尼可刹米(nikethamide)、(S)-可替宁[(S)-cotinine]、氯雷他定(loratadine)、维莫德吉(vismodegib)及非布司他(febuxostat)等。
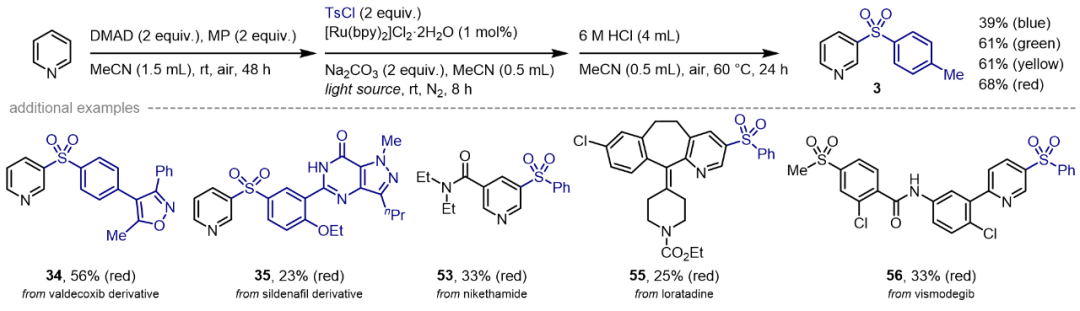
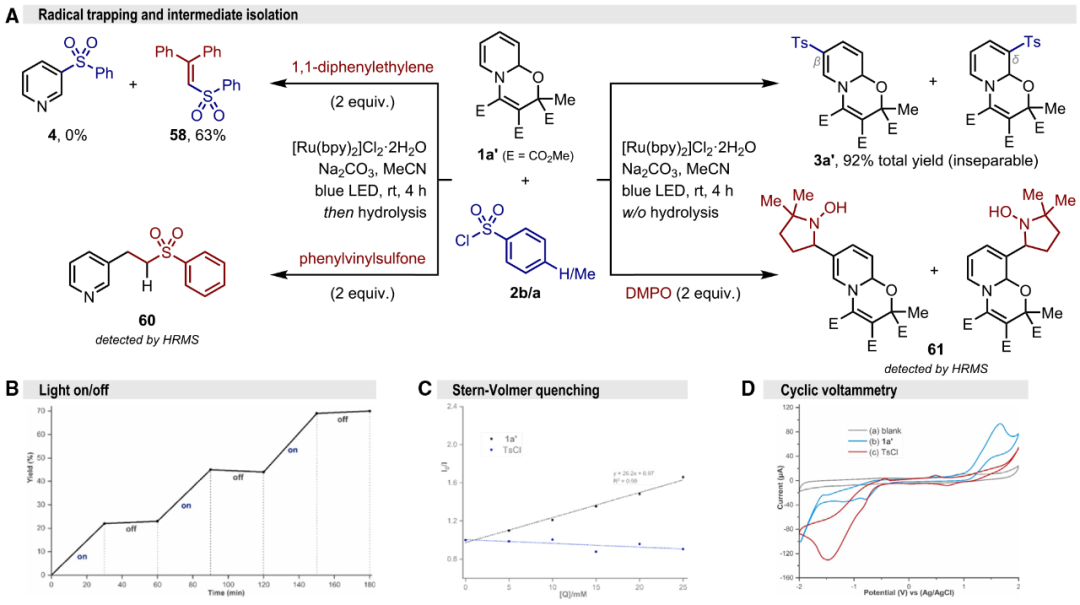
图2. 底物适用性考察(图片来源:Chem Catal.)上述三步反应可通过两锅或一锅法进行(图3),同样,多种光源可以进行反应,不过使用绿光、黄光或近红外光等能量较低光源时,反应收率明显较高。图3. 一锅法合成应用(图片来源:Chem Catal.)为了深入理解反应机制,作者首先进行实验机制研究(图4和图5)。自由基捕获实验证明了噁嗪并吡啶自由基和磺酰自由基的生成;中间体分离实验表明磺酰化可发生在氮原子β-和δ-位;光暗交替实验揭示该反应并非自由基链式反应;光敏剂淬灭实验清楚地表明激发态的光敏剂会被富电子的噁嗪并吡啶进行还原猝灭而驱动反应;在循环伏安法中,噁嗪并吡啶1a’在+1.66 V(vs Ag/AgCl)处出现阳极氧化峰,TsCl则在−1.48 V(vs Ag/AgCl)处显示较宽的还原信号。图4. 机理研究(图片来源:Chem Catal.)上述机理实验很好地支撑了所提出的反应机制(图5)。首先,吡啶、乙酰基二甲酸二甲酯(DMAD)和丙酮酸甲酯(MP)通过氧化还原中性的1,4-偶极环加成得到噁嗪并吡啶1a′;该脱芳构化中间体可还原猝灭激发态的Ru(II)光敏剂,从而转化为自由基阳离子[1a']·+; DFT计算表明该单电子转移(SET)过程的吉布斯自由能垒为13.1 kcal/mol;随后的碱协助脱质子过程为催化循环中的决速步(RDS,能垒约为18.5 kcal/mol),生成的噁嗪并吡啶自由基偏亲核性,可与亲电磺酰自由基[Ru(I)物种与TsCl进行SET过程再生活性Ru(II)光催化剂时所生成)迅速结合,释放至少63.7 kcal/mol的自由能,从而得到β-和δ-磺酰化的混合物。不过最终的酸介导再芳构化步骤将统一得到间位功能化吡啶。图5. 反应机理研究(图片来源:Chem Catal.)吡啶间位磺酰化反应还可通过噁嗪并吡啶、芳基重氮盐和DABSO的三组分偶联反应实现(图6),该反应无需外加光敏剂和碱,上述提到的多种光源(蓝/绿/黄/近红外光)均可驱动反应进行。紫外-可见吸收光谱实验表明DABCO与芳基重氮盐之间形成电子供体-受体(EDA)复合物,该络合物在光照射下进行分子内的SET步骤释放氮气生成芳基自由基生成和DABCO自由基阳离子;该自由基阳离子进而氧化噁嗪并吡啶,随后迅速脱质子生成噁嗪并吡啶自由基。同时芳基自由基捕获DABSO中的SO2产生磺酰基自由基,类似地,两种自由基进行极性匹配的自由基-自由基偶联筑建C−S键。此外,以对甲苯基对甲苯磺酸酯(2a-TT)同时作为磺酰源和电子受体,与DABCO形成EDA聚集体也可实现光化学吡啶间位磺化。图6. EDA光化学活化驱动吡啶间磺化(图片来源:Chem Catal.)综上所述,该团队率先探究了吡啶脱芳构化中间体的氧化还原活性,拓展其化学空间,借助光化学技术解锁吡啶间位功能化修饰,可实现磺酰基、磺酰胺基、三氟甲基多种重要药效团的高效引入,为间位取代的吡啶类药物的快速筑建和结构改造提供了新思路,也为后续基于吡啶骨架化合物库的活性分子筛选提供了物质基础。声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。