Ni催化芳基卤化物与铵盐偶联光化学合成苯胺
苯胺广泛用于合成医药、农药、染料、电子材料等。目前,工业上最常用的制备方法是芳烃先硝化再加氢。然而,使用强腐蚀性酸 HNO3 和 H2SO4 所引起的环境问题以及由此产生的官能团不相容性限制了该方法在实践中的持续使用(方案1A)。在过去十年左右的时间里,Pd-和 Ni 催化的 Buchwald-Hartwig 和 Cu-芳基卤化物与氨/铵盐的催化 Ullmann-Ma胺化已成为苯胺合成的重要方法(方案 1B)。然而,这些方法通常需要使用对空气敏感的金属络合物、合成要求高的配体或强碱,并且芳基卤化物的适用范围有限。虽然直接优先考虑使用氨,但它面临着催化剂失活、单芳基化选择性丧失以及需要高压反应器等困难。为了绕过这些限制,使用了氨替代物,例如甲硅烷基胺、亚胺、叠氮化物、酰胺等等(方案 1B)。但是需要额外的反应步骤来释放游离苯胺,同时产生不需要的副产物。因此,开发高效、选择性和低成本的催化剂系统,用于通过芳基卤化物的 C-N 偶联合成苯胺,尤其是更便宜但反应性较低的芳基氯,仍然具有挑战性。镍络合物介导的光氧化还原催化的最新进展解决了交叉偶联反应面临的一些主要挑战,扩大了它们在更温和条件下的范围。该策略取决于通过光诱导激发的 Ni(II) 络合物均裂产生活性 Ni(I) 物种,从而引发后续反应。然而,尚未报道该策略在苯胺合成中的应用。在此,作者公开了一种通过 Ni(OAc)2-联吡啶络合物催化的芳基卤化物与铵盐的 C-N 偶联来高效且通用的苯胺类光化学合成(方案 1D)。在这项工作进行期间,Reisner 小组报告了芳基卤化物与叠氮化钠的多相光催化交叉偶联,其中活性 Ni(I) 物种通过激发中孔氮化碳产生(方案 1C)。然而,作为氮源,NaN3 具有冲击敏感性、爆炸性和剧毒,并且该方法对芳基氯的效率低下。
作者着手研究 4-氯苯甲酸甲酯偶联的条件 (1)。如表 1 所示,当使用由 Ni(OAc)2和 d-Mebpy(d-Mebpy:4,4'-二甲基联吡啶)原位制备的 Ni(OAc)2-d-Mebpy 络合物作为催化剂时,NH4Br为铵源,DBU为碱,在DMSO和THF的混合溶剂中,在紫光(390-395 nm)的照射下,在没有外加光敏剂的情况下,以87%的分离收率获得了所需的芳基胺(条目 1)。联吡啶配体和镍盐起着至关重要的作用。在所研究的镍催化剂中,Ni(OAc)2-d-Mebpy 络合物表现出最高的活性。同时,作为Ni 源的 Ni(0)(COD)2 络合物也提供了高产率的偶联产物,但它在空气中非常敏感(条目2)。值得注意的是,铵源对于这种 C-N 偶联的成功也很重要。使用氨溶液(条目 3-4)产率低,而使用铵盐获得了更高的产率(条目 5)。光对于反应也是必不可少的,紫光 (390-395 nm) 以最高效率促进 C-N 耦合(条目 1 对 6-8)。当用 Zn(0) 代替光作为还原剂时, C-N 偶联产物的产率很低,仅为 32%(条目 9),而当反应在黑暗中进行时,偶联很少观察到(条目16)。温度也很重要,因为在 30°C 以下获得的产品很少(条目10−12)。可能需要加热以促进 Ni(I) 与芳基卤化物的氧化加成。此外,点亮和熄灭实验表明,整个过程中需要连续照明以维持催化周转,大概是为了生成活性 Ni(I) 催化剂来自非循环 Ni(II) 物种。值得注意的是,氧气的存在会显着降低反应效率(条目13)。
碱的选择对偶联的成功也有很大影响(条目 14)。在所研究的碱中,无机碱均无效,只,温和的可溶性 DBU 促进反应的效果明显优于其他有机碱。对照实验表明,在没有有机碱、配体和光的情况下,反应不会进行(条目 14-16)。

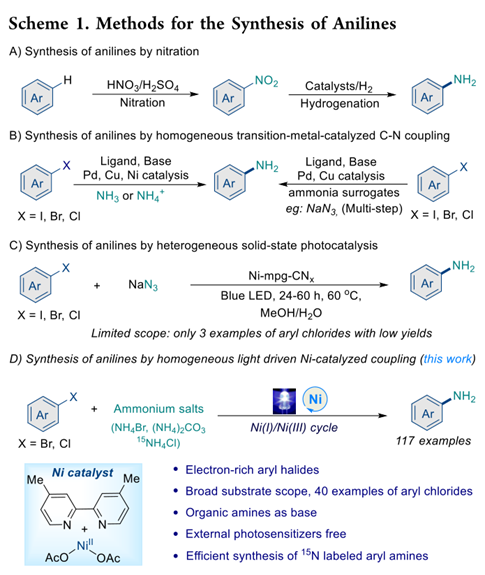
有了优化的条件,作者探索了反应范围。如表 2,各种电子中性、富和缺电子的芳基氯可以与 NH4Br 有效偶联,通常以高收率提供所需的芳基胺 (2-20)。在苯环的对位具有吸电子取代基如 -CO2Me、-CN、-CF3 和 -COR(R = Me、环丙基和 Ph)的芳基氯与 NH4Br 偶联,以优异的产率提供所需的产物(2−7)。除三氟甲基外,这些官能团为后续的转化提供了机会。由于使用弱胺碱,所有含有酯基和氰基的亲电子试剂都可以接受,从而以良好的收率提供苯胺 (2−3, 12−18)。相比之下,强碱的使用可能导致偶联反应中形成酯交换产物和杂质。含有-SMe、-tBu 和-Ph 等取代基的未活化芳基氯在该方案中兼容(8−10)。然而,含有更多供电子 −OMe 取代基的底物 (11) 的产率较低。同时,位阻芳基氯也具有适应性,以良好的收率提供所需的芳基胺 (13−15)。具有敏感官能团的二取代芳基氯也可以有效地参与反应 (14-20),并且没有观察到与二氯 (19) 和 Bpin (20) 基团的进一步反应。含有吡啶(21-22)、喹啉 (23-24)、喹唑啉 (25) 和噻萘 (26) 的(杂)芳基氯也是相容的,这在药物化学中很重要。
该方法的实用性也在药物分子和衍生物的最新修饰中得到证明。抑霉唑(27,杀菌剂),氯雷他定(28,抗组胺药),益康唑(29,抗真菌药),扑尔敏(30,抗组胺药),腈菌唑(31,杀菌剂),非诺贝特(32,用于混合性血脂异常或原发性高胆固醇血症),和氯化物多样化生育酚 (33) 适用于该催化剂体系,提供高效的胺化衍生物。
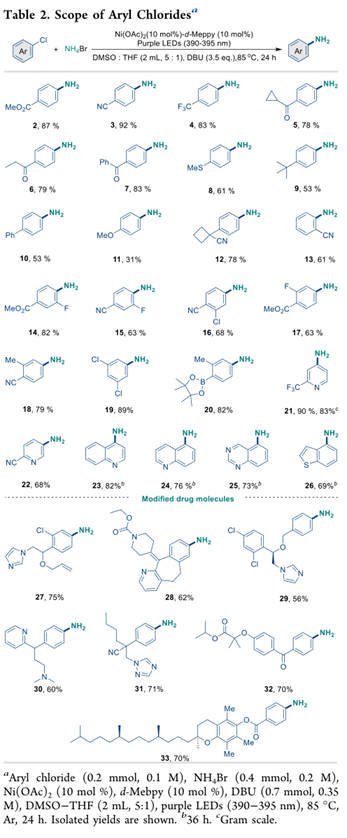
接下来,检查了芳基溴化物的范围。如表3 中总结的那样,无论芳基溴化物的电子特性如何,碳酸铵都能有效地进行反应,通常以高产率提供所需的苯胺。与溴化铵相比,碳酸铵的使用减少了有机碱的用量,同时提供了相似的产品收率。因此,在对位或间位带有吸电子取代基的芳基溴化物,例如 -CO2Me、-F、-Cl、-Br、-CF3、-CN、-CH2CN、吡咯、磺酰胺和酰胺,都可以生成产物具有良好到极好的产率 (2−4, 34−38)。特别是,对于带有电子中性和富电子取代基的芳基溴化物,可以高产率获得相应的胺(39-42、10-11 和 43-47)。此类底物通常难以进行光氧化还原 C-N 交叉偶联反应。此外,44 中的乙烯基单元在偶联反应期间保持完整。令人欣慰的是,对空间要求更高的邻位取代芳基溴化物也能以高产率提供所需的产物 (12, 48-60)。
双取代的芳基溴化物也取得了成功(58-61),突出了该 C-N 偶联反应中芳基亲电子试剂的广泛范围。更令人感兴趣的是,一系列(杂)芳基溴化物是相容的,提供含有吲哚 (64)、苯并呋喃 (67)、噻吩 (68)、苯并噻吩的芳基胺(69-71)、吡啶 (72-82)、嘧啶 (83-84)、苯并噻唑 (85-86)、喹啉酮 (23、88) 和异喹啉 (87)。与芳基氯的情况一样,该方法也可应用于带有芳基溴单元的类药分子的后期修饰。在雌酮(89)、氟马西尼 (91)、吉非贝齐甲酯 (92) 和其他复杂分子 (90、93) 的合成中可以看到这样的例子,收率很高。连同芳基氯的例子,用芳基溴获得的结果证明了这种光驱动的 Ni(II) 催化方案在合成各种苯胺方面的巨大潜力。
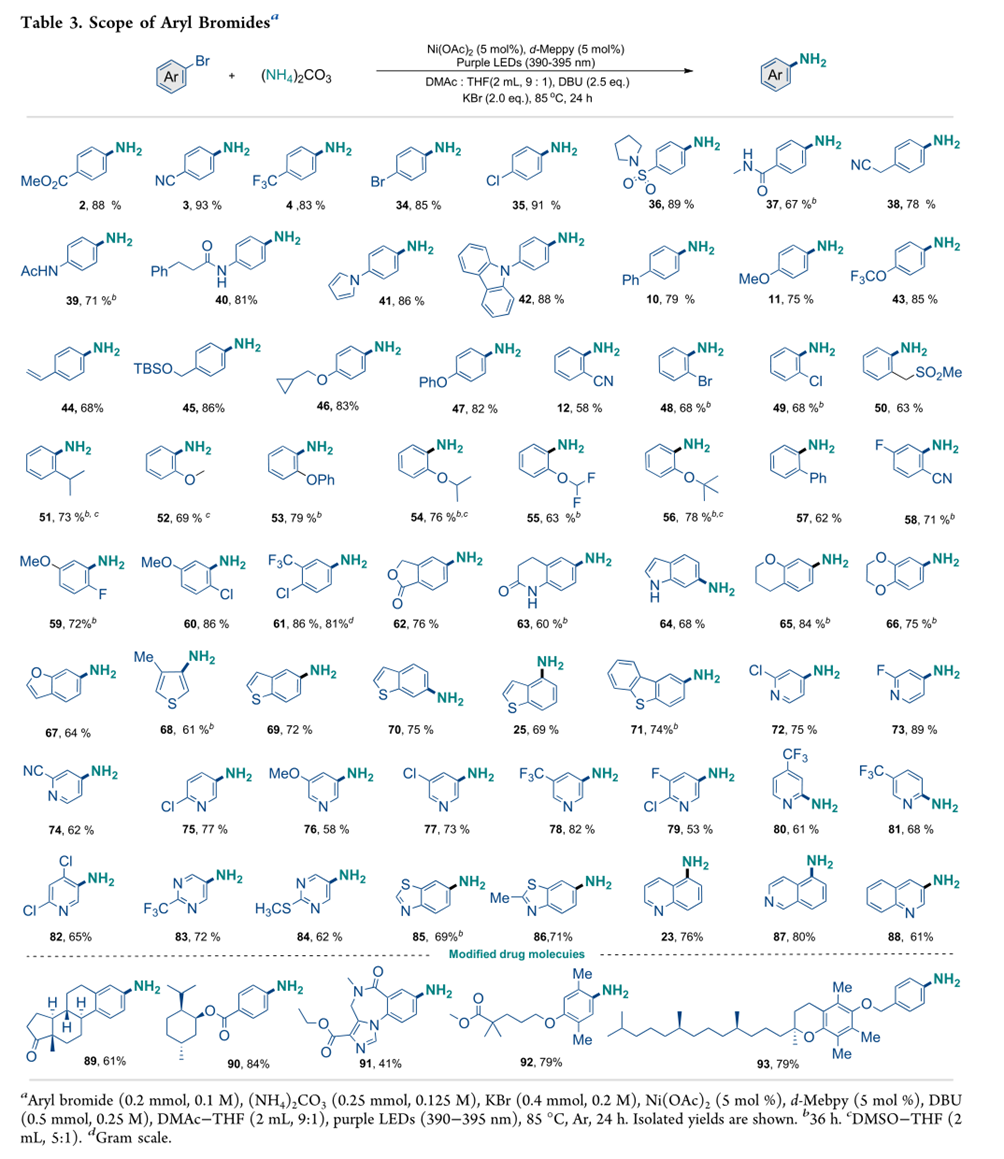
15N 标记的苯胺的简便合成进一步证明了该方法的实用性。如表 4,使用这种光驱动的 Ni(II) 催化的 C−N 偶联反应,可以使用市售的 15NH4Cl 轻松获得 15N 标记的苯胺。如表 4 所示,含硼酯 (94−95)、硅烷 (96)、吡咯的芳基卤化物(97)、咔唑 (98)、酮 (101、102)、酰胺 (103)、磺胺 (105)、多取代基 (104、106−107、110)、吡啶 (108) 和噻吩 (109) 均有效偶联,仅需要 2 当量的 15NH4Cl,同时以良好的收率提供重要的 15N 标记的芳基胺。值得注意的是,可以很容易地对生物活性分子和药物分子进行 15N 标记。
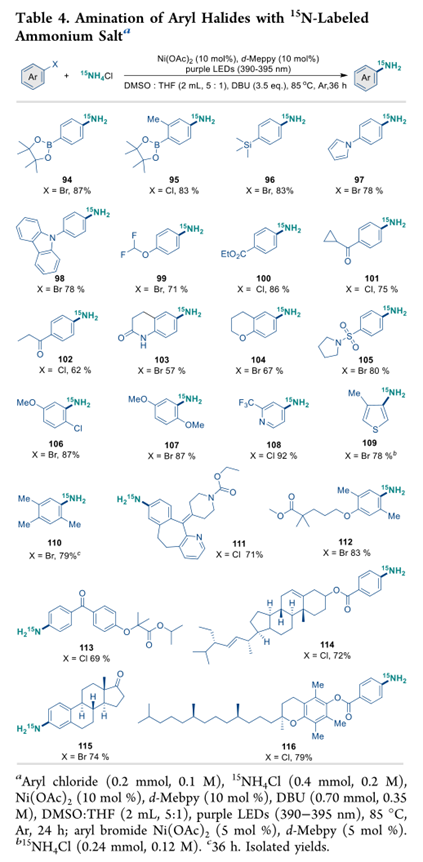
在 15N 标记的氯雷他定 (111)、吉非贝齐甲酯 (112)、非诺贝特 (113)、雌酮 (115)、生育酚 (116) 和卤化复合分子 (114) 的合成中可以看到示例。因此,该方法为合成15N 标记的苯胺和类药物分子提供了一种方便的工具。
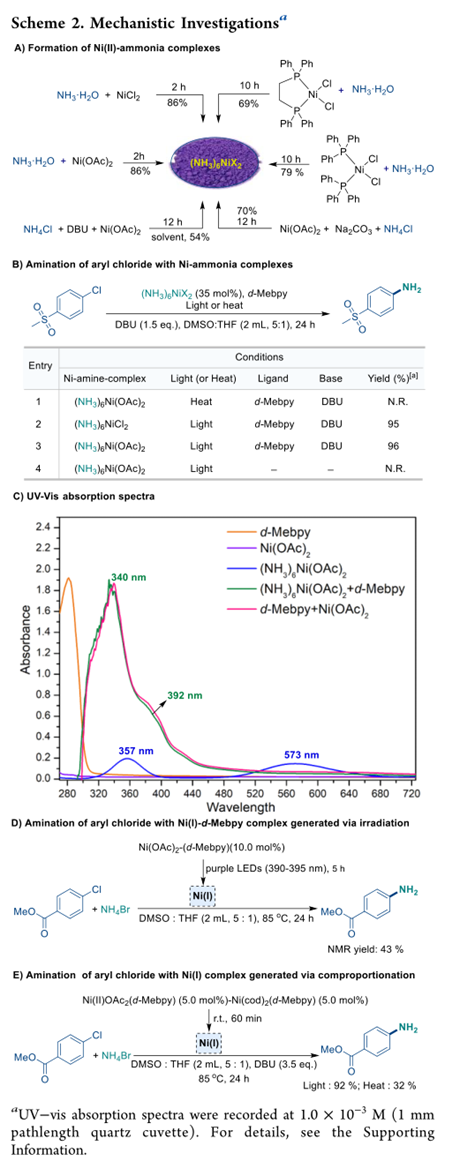
进行了初步研究以了解可能的反应机理。首先,研究了氨与镍配位的可能性以及所得络合物对反应的影响。如方案 2 所示,氨或铵盐可以很容易地将各种 Ni(II) 化合物转化为氨连接的 [(NH3)6Ni(II)]X2,产率高。但是, 镍络合物 [(NH3)6Ni(II)]X2在热催化或光催化条件下均不能参与 C−N 偶联反应(方案 2B)。相反,在引入d-Mebpy配体和光照射后,以高产率获得了所需的产物,强调了配体和光在此偶联反应中的关键作用。
UV-vis和HRMS光谱揭示了形成的镍-联吡啶络合物。络合物 [(NH3)6Ni(II)](OAc)2显示出类似于八面体 Ni(II)-氨络合物的吸收特征。当引入联吡啶配体时, Ni(II)-氨络合物的吸收带消失,取而代之的是 340 nm 处的新吸收带,其肩峰位于 392 nm 处。当Ni(II)(OAc)2与d-Mebpy反应时,也看到了相同的吸收,表明在[(NH3)6Ni(II)](OAc)2的情况下,形成了[Ni(OAc)2(d-Mebpy)]并被d-Mebpy完全取代了NH3。为了支持这一推测,气相色谱分析检测到了氨气。 [(NH3)6Ni(II)](OAc)2和 d-Mebpy 混合物的 HRMS 揭示了 301.0483处的 m/z 峰,这与 [Ni(II)(OAc)(d-Mebpy) ]+ 或 [Ni(OAc)2(d-Mebpy)]的形成一致。因此,该 C-N 偶联反应的活性催化剂似乎衍生自不带有配位 NH3 的 Ni(II)-联吡啶预催化剂。
还进行了额外的探测反应。当预制的[Ni(OAc)2(d-Mebpy)] 复合物在没有底物的情况下在 390-395 nm 下照射 5 小时,然后在黑暗中与 4-氯苯甲酸甲酯和溴化铵反应,所需的产物在 24 小时内以 43% 的收率获得(方案 2D)。在作者之前的研究中, Ni(OAc)2-联吡啶络合物显示通过光诱导的 Ni 均裂裂解产生 Ni(I) 物种- OAc 键,然后与芳基卤化物进行氧化加成。根据Ni(I)物种是活性催化剂的假设,当在热条件下进行相同的偶联时,[Ni(OAc)2(d-Mebpy)]和[Ni(0)(d-Mebpy)(Cod)]络合物原位生成Ni(I)络合物(方案2E)时,也观察到类似的产率。这些热反应的产率明显低于在光催化条件下获得的产率,突出了在催化过程中需要光。
基于这些观察结果和最近几个小组对光促进的 Ni 催化的 C-O 和 C-N 偶联反应的机理研究,在方案 3 中提出了一种简化的胺化机理途径。辐照Ni(OAc)2-d-Mebpy复合物在 390-395 nm 处激发 Ni(II) 复合物 I,通过 Ni-OAc 键的光诱导均裂裂解产生 Ni(I) 物种 II。然后 Ni(I) 物质与芳基卤化物反应生成Ni(III)-Ar 中间体 III,其与氨连接生成Ar-Ni(III)-NH3 IV。 DBU对配位 NH3的去质子化产生 Ar-Ni(III)-NH2 V,它经过还原消除以提供 C-N 偶联产物,同时再生 Ni(I) 物种。连续照明是必要的。这可能是由于 Ni(III) 和 Ni(I) 的歧化或 Ni(III)-Ar 中间体的均裂形成了非循环的催化惰性 Ni(II) 物种,这需要连续照射转化为活性 Ni(I),从而维持催化转换。
综上所述,作者发展了一种高效的芳基卤化物与铵盐的光化学C-N偶联反应。该反应在光的直接激发下由易得的Ni(OAc)2-d-Mebpy络合物催化,不需要任何外部光敏剂。通过110多个实例的报道,这种偶联方案在苯胺的合成、药物分子的后期修饰和伯芳胺的15N标记方面展示了实用的适用性。
DOI:10.1021/acscatal.2c04959




