【JACS Au】无催化剂、仅靠光化学实现烯烃的氢膦化反应
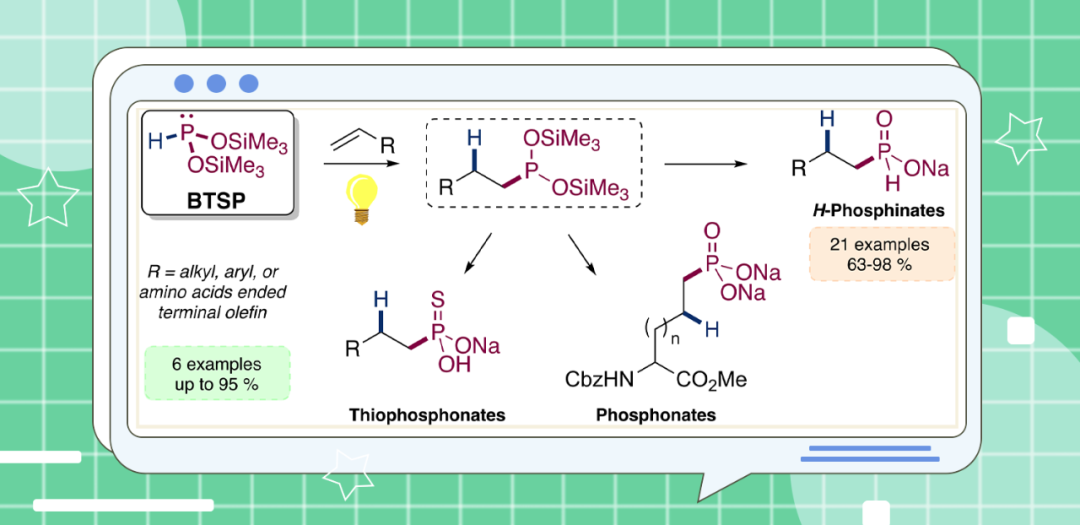
近日,美国麻省理工学院Christopher C. Cummins与法国蔚蓝海岸大学/摩洛哥穆罕默德六世理工大学Rachid Benhida团队开发了一种新型功能化膦衍生物的合成路线。其中,以H₃PO₂为原料高效制备的双(三甲基硅基)亚膦酸酯HP-(OSiMe₃)₂是一种在紫外线照射下对活化、非活化和氨基酸衍生烯烃进行氢膦化(hydrophosphination)的优良试剂,且无需催化剂、无需溶剂且无需手套箱操作的条件。其次,所得三价膦化合物经后期官能团化,可以良好至优异的产率获得相应的H-次磷酸酯(H-phosphinate)、膦酸酯及硫代膦酸酯产物。机理研究表明,反应涉及自由基的反应机理。相关研究成果发表在JACS Au上。
有机膦化合物在药物化学(抗病毒、抗生素、抗肿瘤等)、金属催化转化及有机领域具有广泛应用。近年来,P−C键形成反应引起了相当大的关注。氢膦化反应(即含P−H键的三价膦化合物与不饱和底物的加成反应)已成为构建新型P−C键的原子经济性策略。然而,氢膦化反应仍存在一定的挑战,如官能团耐受性以及膦底物的范围有限(主要为Ph₂PH和PH₃)等。最近,金属催化氢膦化领域已取得显著进展,通过调控辅助配体实现了反应性能优化。同时,还开发了无溶剂/无引发剂反应体系,并探索了2-甲基四氢呋喃等溶剂的应用。此外,对映选择性氢膦化反应也成功的实施,为手性膦化合物合成提供了新途径。P−C键的形成也可以通过使用自由基引发剂(Et₃B/O₂;AIBN)的hypophosphites和不饱和烃之间的自由基氢膦酰化反应或过渡金属催化的反应(如交叉偶联反应),从而产生次磷酸酯化合物。尽管已取得了上述的进展,但底物范围仍然有限。近日,Christopher C. Cummins与Rachid Benhida团队开发了一种光化学策略,即HP-(OSiMe₃)₂与烯烃衍生物进行氢膦化反应,且无需催化剂、无需溶剂以及无需手套箱操作等条件。同时,通过后期官衍生化,可进一步转化为相应的H-次磷酸酯、膦酸酯及硫代膦酸酯衍生物(Figure 1)。
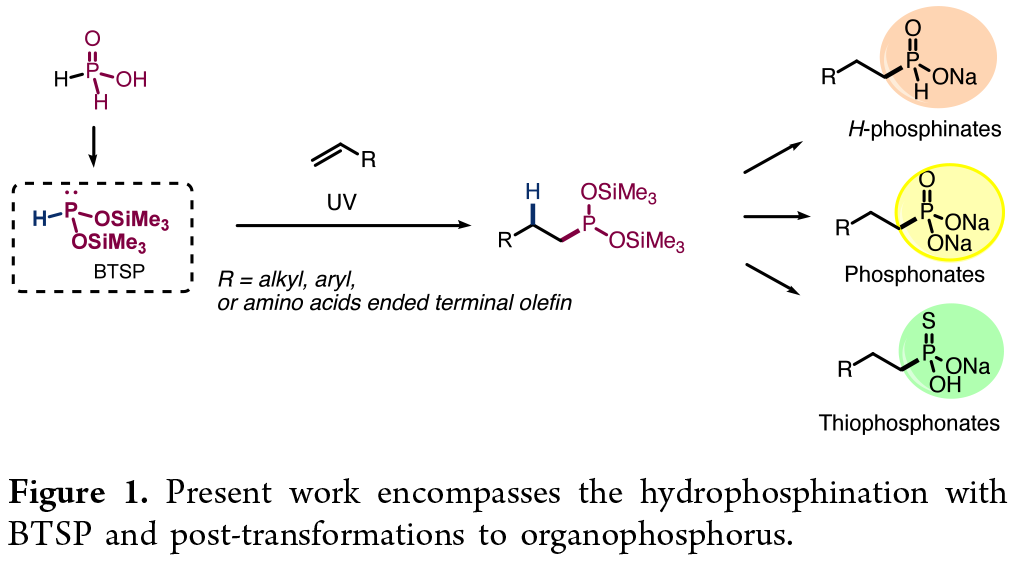
(Figure 1,图片来源:JACS Au)
首先,作者探索了四种互补性合成亚膦酸酯2的方法,该中间体可直接用于后续得原位氢膦化反应(Figure 2)。这些方法的主要区别在于起始酸的性质(无水或含水体系)、硅烷化步骤(HMDS与BSA的选择)以及是否形成中间体1-salt。研究初期,作者选用了Method A,即以次磷酸1为原料,通过N,O-双(三甲基硅基)-乙酰胺(BSA)硅烷化试剂处理,原位生成BTSP(2a)。
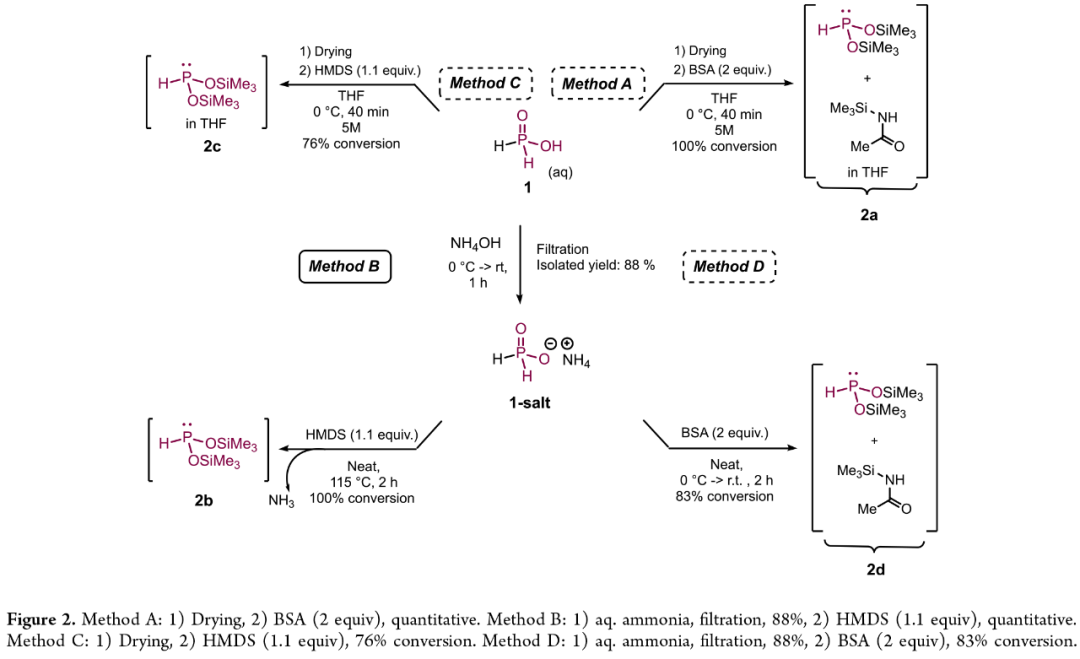
(Figure 2,图片来源:JACS Au)
其次,作者选用不同的BTSP(2)与己烯作为模型底物,对反应条件进行了大量的筛选(Table 1)。筛选结果表明,当以BTSP(2b)作为膦化试剂,在254 nm的紫外线照射下,可直接与己烯(2 equiv)进行氢膦化反应,可以100%的转化率得到产物3a。
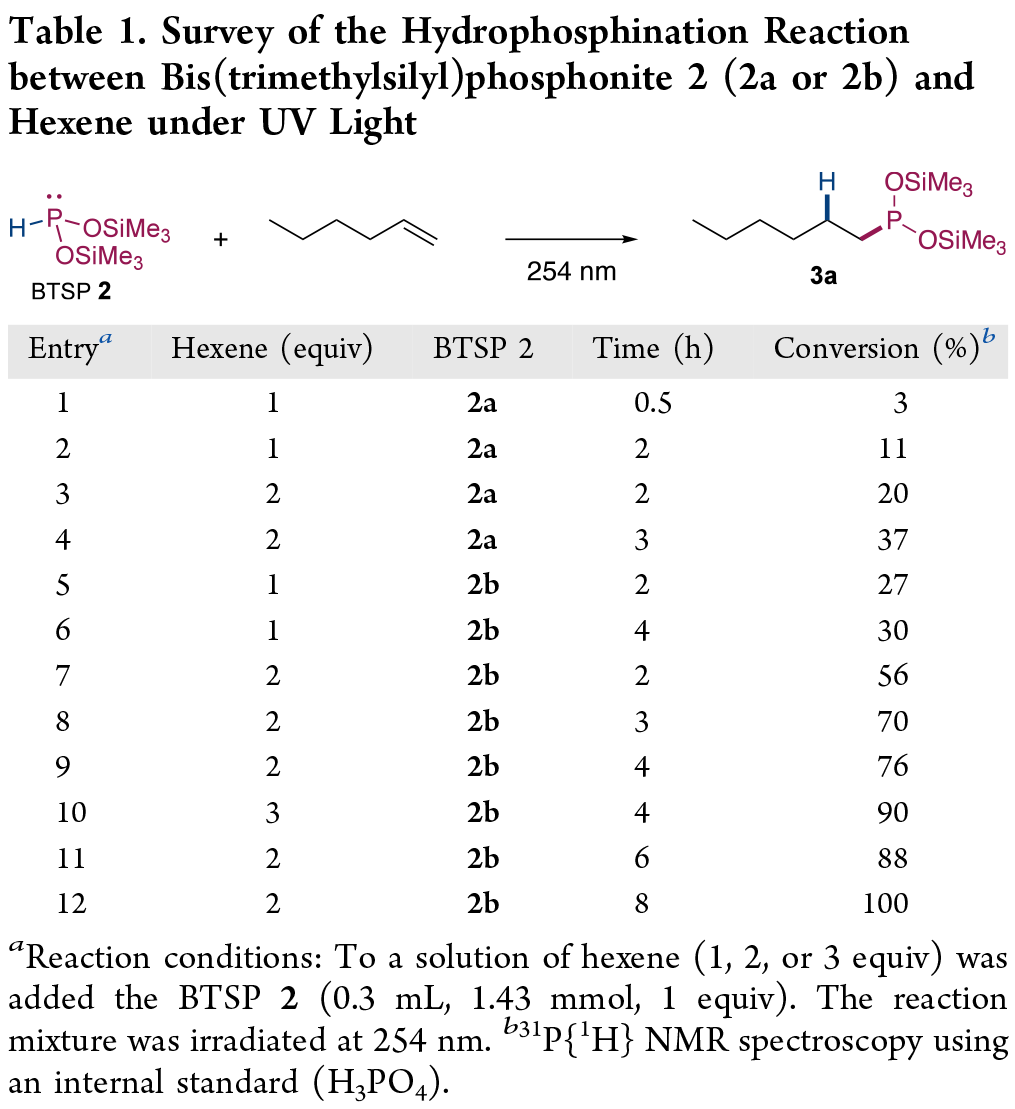
(Table 1,图片来源:JACS Au)
为了进一步了解BTSP(2b)与己烯的反应过程,作者对反应的过程进行了³¹P{¹H}-³¹P NMR研究(Figure 3)。研究结果表明,反应过程中形成了亚膦酸酯(3a)以及稳定/可分离的4a-salt等中间体。
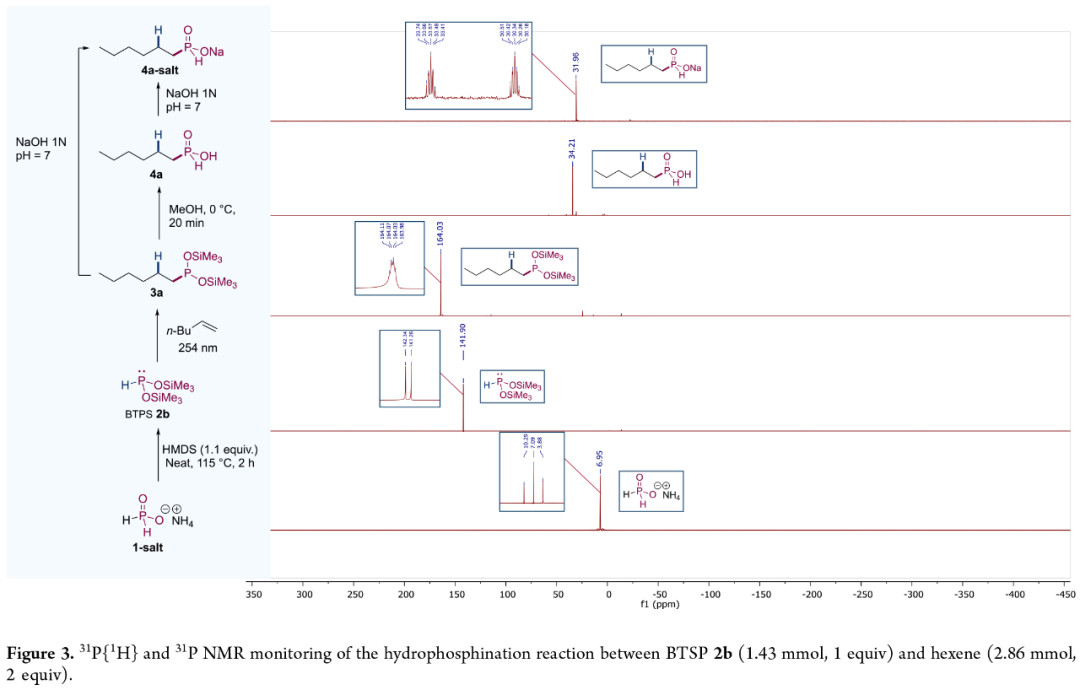
(Figure 3,图片来源:JACS Au)
同时,作者还对BTSP(2b)与己烯反应进行了灯开关实验的研究(Figure 4)。研究结果表明,在无光的条件下,反应均未能进行,进一步证明了紫外线照射对于反应的重要性。
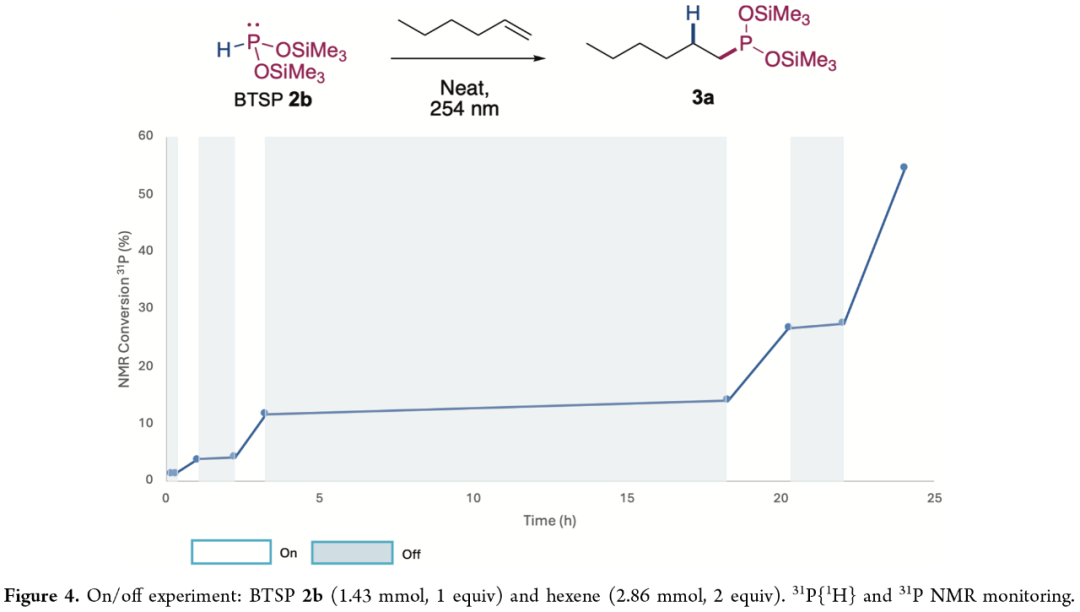
(Figure 4,图片来源:JACS Au)
为了确定反应是否涉及自由基过程,作者使用1,1-二氟-2-乙烯基环丙烷进行了自由基清除实验的研究(Figure 5)。研究结果表明,反应涉及自由基的生成过程。
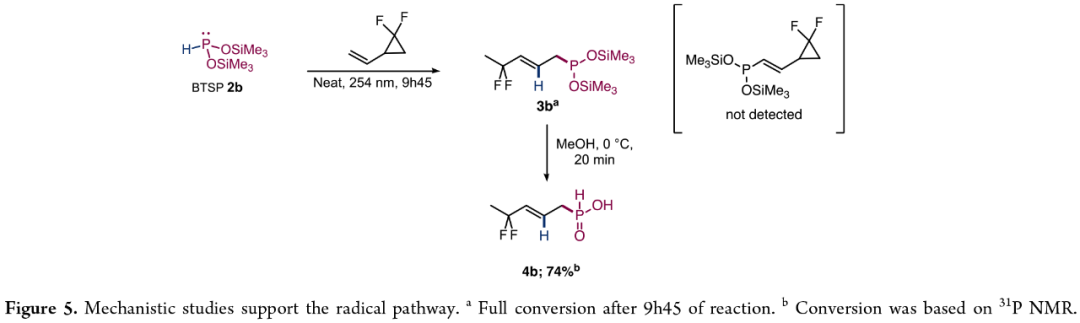
(Figure 5,图片来源:JACS Au)
基于上述的研究以及相关的理论计算,作者提出了一种合理的氢膦化反应机理(Figure 6)。计算结果表明,反应涉及一种逐步的机理。首先,在光照条件下,HP(OSiMe₃)₂可生成膦为中心的自由基,其可与烯烃底物反应(涉及TS1)。同时,过渡态TS1和TS2的相对自由能略高于HP(SiCl₃)₂中的类似物。此外,实验与理论计算研究共同揭示,氢膦化反应遵循自由基反应机理,且HP(OSiMe₃)₂与HP(SiCl₃)₂因P−Si键与P−O键本质差异导致显著理化性质区别。该差异主要体现于P−H键均裂活性、自由基稳定性以及整体反应活性。
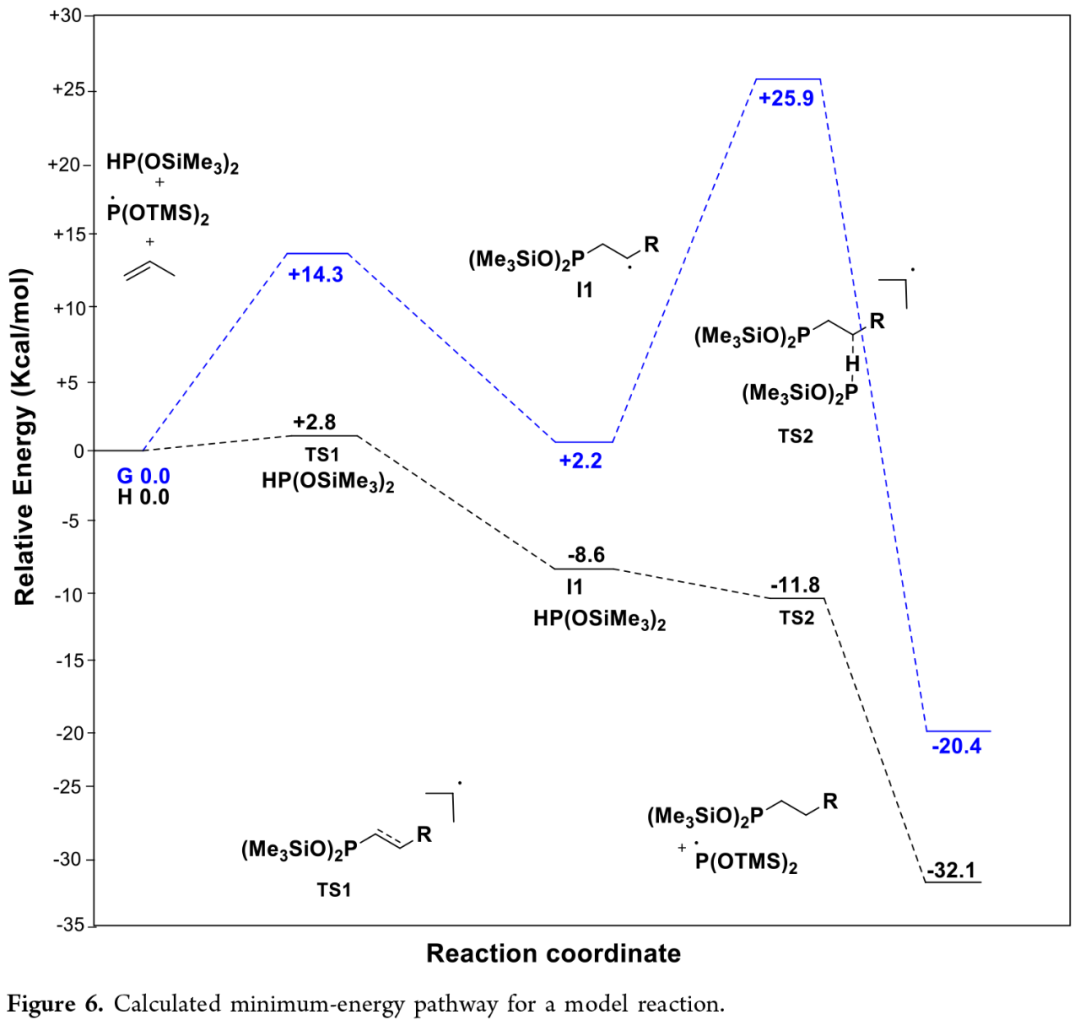
(Figure 6,图片来源:JACS Au)
紧接着,作者还对P(OSiMe₃)₂与HP(SiCl₃)₂的反应性差异进行了研究(Figure 7)。研究结果表明,HP(SiCl₃)₂不能与4-乙烯基环己烯、(S)-柠檬烯和苯乙烯反应。值得注意的是,BTSP(2b)可选择性与末端烯基反应,这证明了氢膦化反应的区域选择性特征及自由基反应模式。通过后续的衍生化,可分别获得相应的H-次磷酸酯衍生物4c-salt、4e-salt和4e-salt。
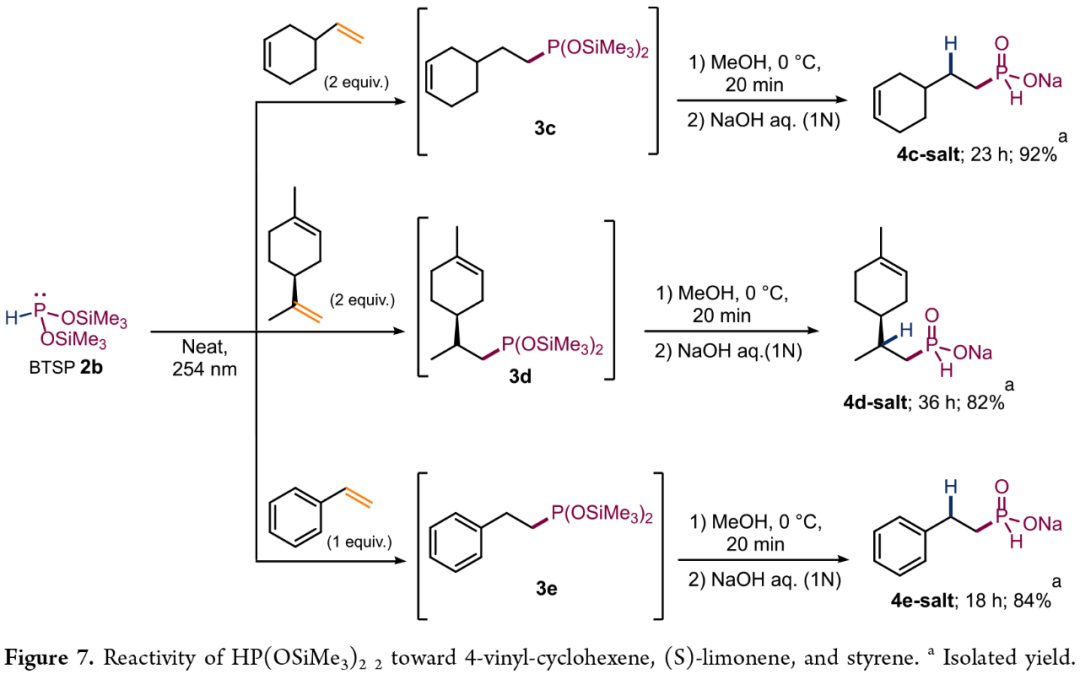
(Figure 7,图片来源:JACS Au)
随后,作者通过连续的一锅三步法(即氢膦化反应、甲醇解反应(methanolysis)及氢氧化钠溶液处理),对一系列烯烃的底物范围进行了扩展(Figure 8)。研究结果表明,一系列脂肪族烯烃以及不同电性取代的芳香族烯烃,均可顺利进行反应,获得相应的H-次磷酸酯产物4a-salt-4-salt,收率为70-98%,并具有独特的anti-Markovnikov选择性。
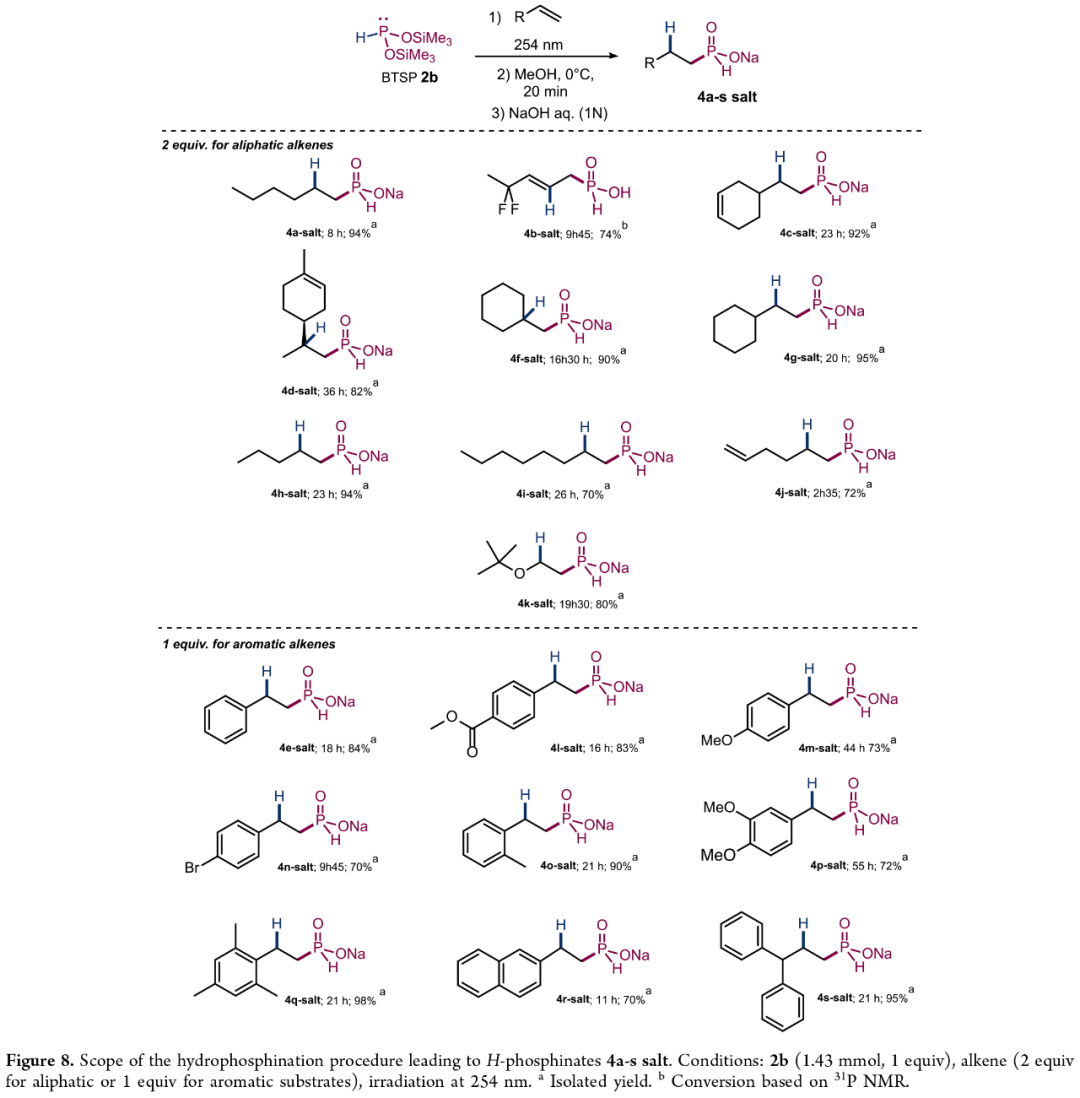
(Figure 8,图片来源:JACS Au)
此外,作者对反应的实用性进行了研究(Figure 9)。首先,3a或3e在I₂/DMSO条件下进行氧化反应,可分别获得相应的膦酸酯衍生物5a-salt(95%)和5e-salt(88%)。其次,3a或3e在S₈/Et₂O条件下进行硫化反应,并在碱性水溶性中进行水解,可分别获得相应的硫代膦酸酯衍生物6a-salt(82%)和6e-salt(78%)。
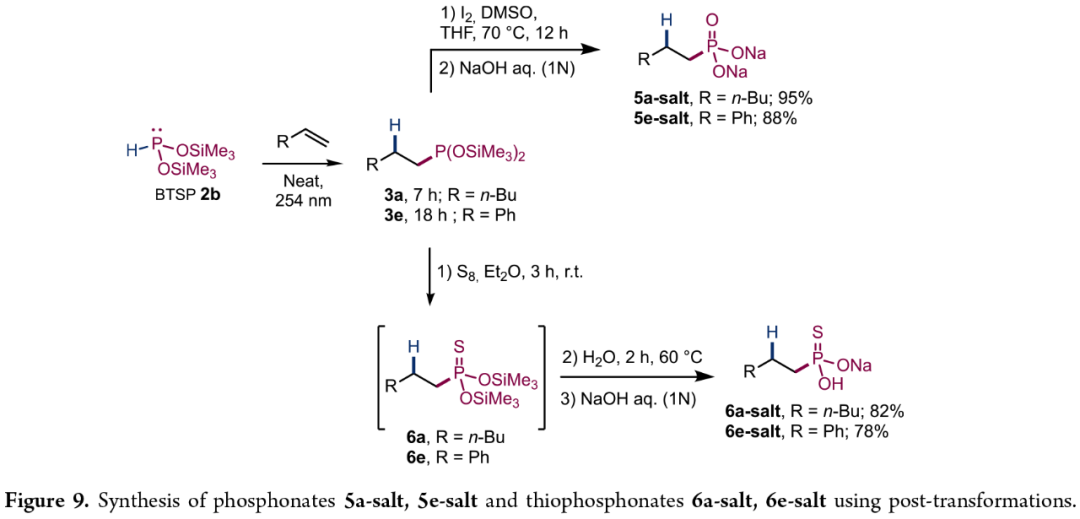
(Figure 9,图片来源:JACS Au)
同时,BTSP(2b)还可与L-乙烯基甘氨酸和L-烯丙基甘氨酸进行氢膦化反应,随后进行的甲醇解及pH调节过程,可以良好收率得到非天然α-氨基酸H-次膦酸酯产物11-salt(63%)和12-salt(73%)。并且,将化合物9和10氧化后调节pH,继而得到相应膦酸酯产物13-salt(71%)与14-salt(60%)(Figure 10)。
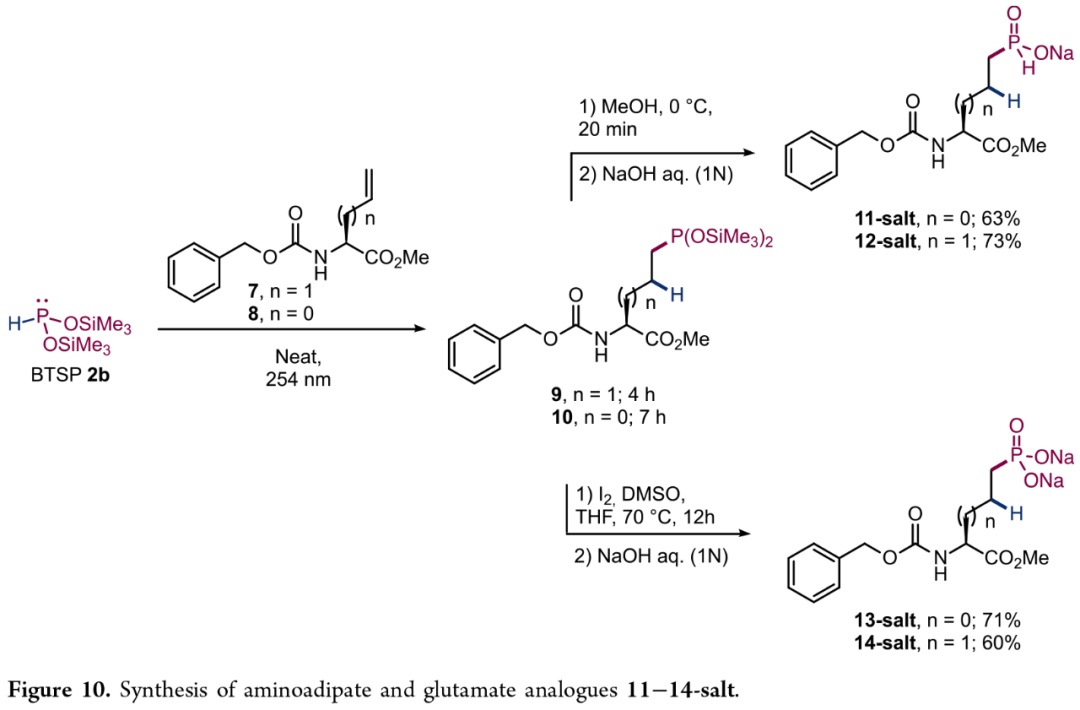
(Figure 10,图片来源:JACS Au)
Christopher C. Cummins与Rachid Benhida团队开发了一种光化学策略,即HP-(OSiMe₃)₂与烯烃衍生物进行anti-Markovnikov氢膦化反应,且无需催化剂、无需溶剂以及无需手套箱操作等条件。同时,通过后期官衍生化,可进一步转化为相应的H-次磷酸酯、膦酸酯及硫代膦酸酯衍生物。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




