【Nat. Commun.】吡啶的光化学C3-位胺化反应(涉及Zincke亚胺中间体的形成)
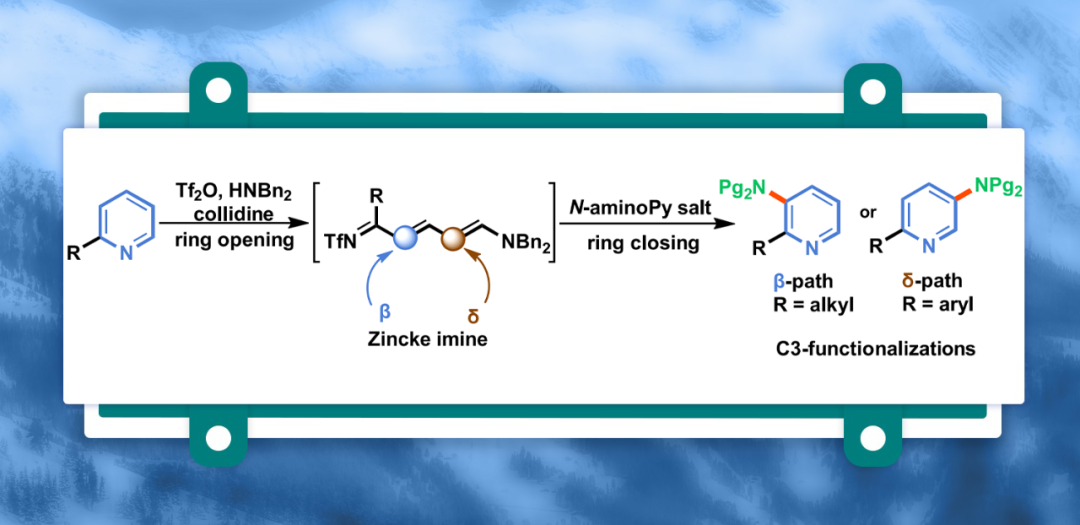
吡啶骨架与外围位点的选择性编辑显著拓展了化学空间。尽管该杂芳环固有的反应性可实现C2-和C4-位的C-H官能团化,但C3-位的选择性官能团化长期面临重大挑战。近期,基于去芳构-再芳构化(dearomatization-rearomatization)串联过程(涉及Zincke亚胺中间体),已实现了选择性卤代(-Br、-Cl、-I)及同位素标记。近日,波兰科学院有机化学研究所Dorota Gryko与西班牙拉里奥哈大学Ignacio Funes Ardoiz团队开发了一种温和、区域选择性的C3-胺化方法,该方法依赖于Zincke亚胺与N-氨基吡啶盐产生的酰胺基(amidyl)自由基进行的光化学反应。机理与理论研究表明,反应涉及自由基中间体的形成,并解释了反应的C3-区域选择性。相关研究成果发表在Nat. Commun.上。
杂环骨架广泛存在于众多天然产物、药物、农用化学品中,并在材料科学领域占据重要地位。其中,吡啶基团是获已获批药物中最常见的结构基序之一(Fig. 1A)。由于生物活性可通过该核心结构的取代模式精细调控,因此化学家们一直致力于开发吡啶的官能团化方法。前期,化学家们开发了多种吡啶的外围位点编辑(peripheral editing)策略,但由于其固有的反应性,C2-与C4-位点官能团化仍占主导地位,而C3-位的化学修饰始终面临显著挑战。经典的C3-卤代或C3-硝化反应通过亲电芳香取代实现,但存在反应条件苛刻、吡啶底物过量消耗及区域选择性低等问题(Fig. 1B)。在这种方法中,缺电子azines转化为富电子中间体(烯胺、二烯胺),使其能够与亲电试剂反应,继而通过再芳构化过程,生成C3-取代吡啶衍生物。基于Zincke亚胺官能团化反应以及对于二烯醇醚在光化学胺化反应的持续研究,近日,Dorota Gryko与Ignacio Funes Ardoiz团队开发了一种光催化吡啶的区域选择性C3-胺化反应(Fig. 1C)。其中,由N-氨基吡啶盐经光化学过程产生的氮中心自由基,可与Zincke亚胺发生反应,最终经再芳构化过程,可区域选择性地生成C3-氨基吡啶衍生物。
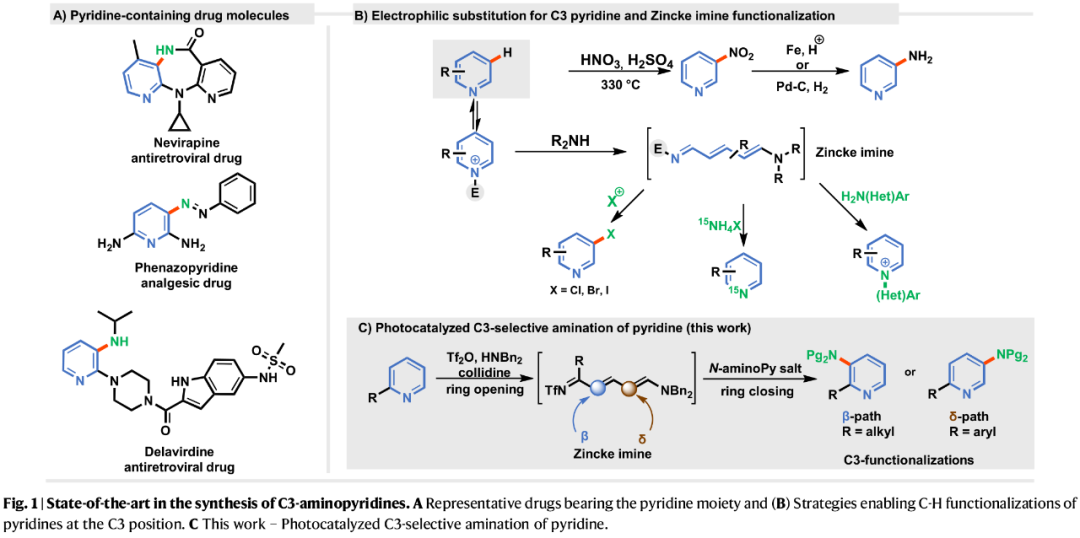
(Figure 1,图片来源:Nat. Commun.)
最初,作者以2-苯基吡啶(1)制备的2-苯基Zincke亚胺(2)为模型底物,在fac-Ir(ppy)₃的存在下,于蓝光照射下与氨基吡啶盐反应,经连续关环过程后,成功获得目标产物3,但其产率较低(Fig. 2A)。DFT计算表明,由于较低的过渡态能量,δ-位C-N键的形成应比β-位占主导地位(Fig. 2B)。
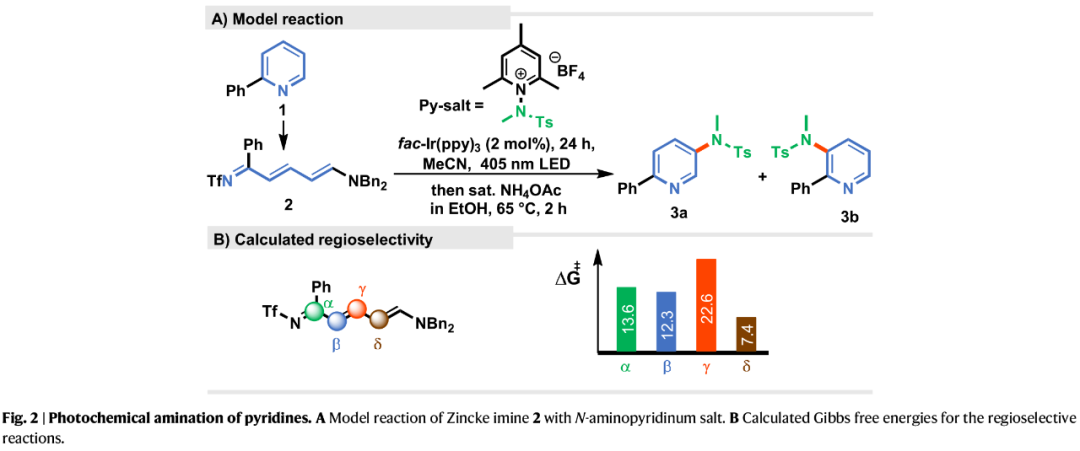
(Figure 2,图片来源:Nat. Commun.)
其次,作者以2-苯基Zincke亚胺(2)与N-氨基吡啶盐作为模型底物,对反应条件进行了大量的筛选(Table 1)。筛选结果表明,当以fac-Ir(ppy)3作为光催化剂,紫色LED(405 nm)作为光源,DMSO/MeCN (v:v 1:1)作为溶剂,在0 ℃下反应24 h后,再经饱和NH₄OAc/乙醇中处理,可以95%的分离收率获得目标的C3-氨基吡啶产物3,为两种区域异构体3a和3b的混合物,3a:3b为4.8:1。
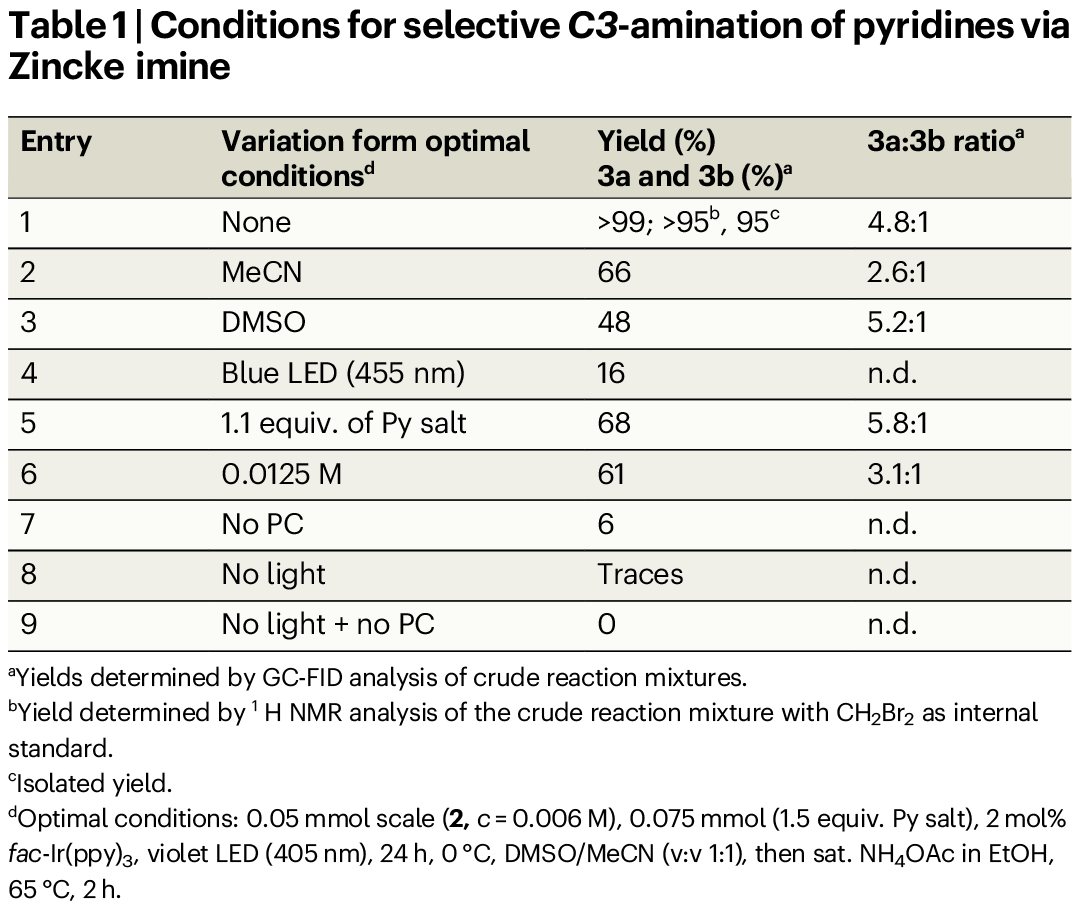
(Table 1,图片来源:Nat. Commun.)
前期研究表明,处于激发态的Ir(III)可通过单电子转移(SET)过程,在蓝光LED照射下可将N-氨基吡啶盐还原为氮中心自由基。有趣的是,上述研究发现,反应的产率显著降至16%,这可能源于Zincke亚胺(2)在450 nm附近存在强紫外-可见光吸收(entry 4, Fig. 3)。因此,紫光(405 nm)照射是激发铱催化剂的关键因素,从而实现在Zincke亚胺存在下高效生成酰胺基自由基。
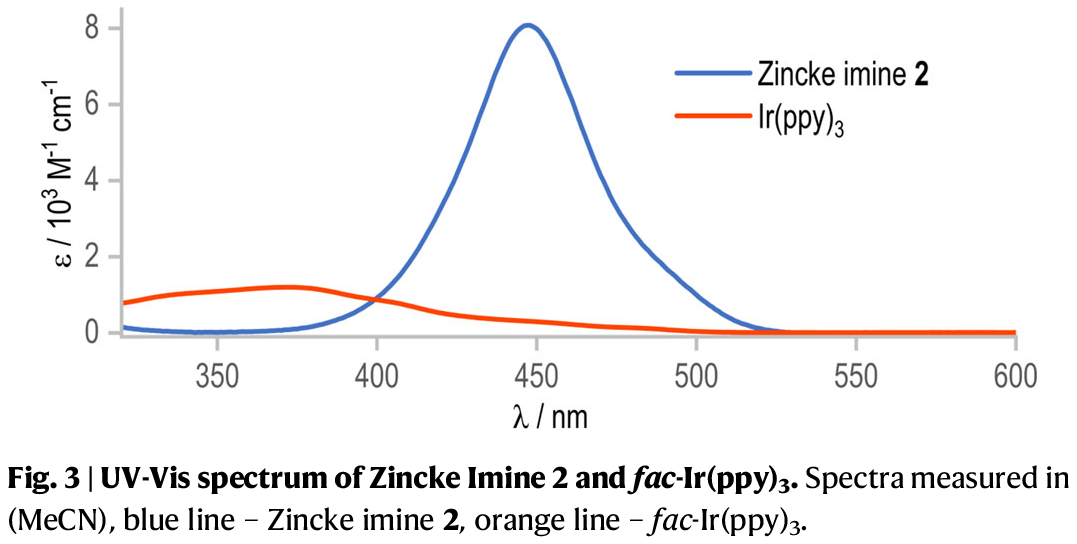
(Figure 3,图片来源:Nat. Commun.)
在获得上述最佳反应条件后,作者对吡啶的底物范围进行了扩展(Fig. 4)。首先,当吡啶底物中的2-位含有不同电性取代的芳基时,均可顺利进行反应,获得相应的产物3a-23a,收率为26-98%,a:b为2.9:1->20:1。其中,由于空间效应,导致产物7a的收率明显降低。值得注意的是,对于2-位含有菲基、芘基以及4-氰基/4-硝基取代的芳基时,反应具有优异的区域选择性,如17a-20a。其次,2-杂芳基取代的吡啶,也是合适的底物,获得相应的产物24a-29a,收率为26-86%,a:b为1:1.5-12:1。此外,通过对反应条件的优化后发现,对于2-烷基取代的吡啶,反应的区域选择性发生了翻转,获得相应的产物30b-32b、33a、34b和35a,收率为44-79%,b:a为1:0.7-15:1。其中,异丙基和甲氧基取代的苄基衍生物是个例外,它们几乎没有选择性地形成胺化产物33和35。
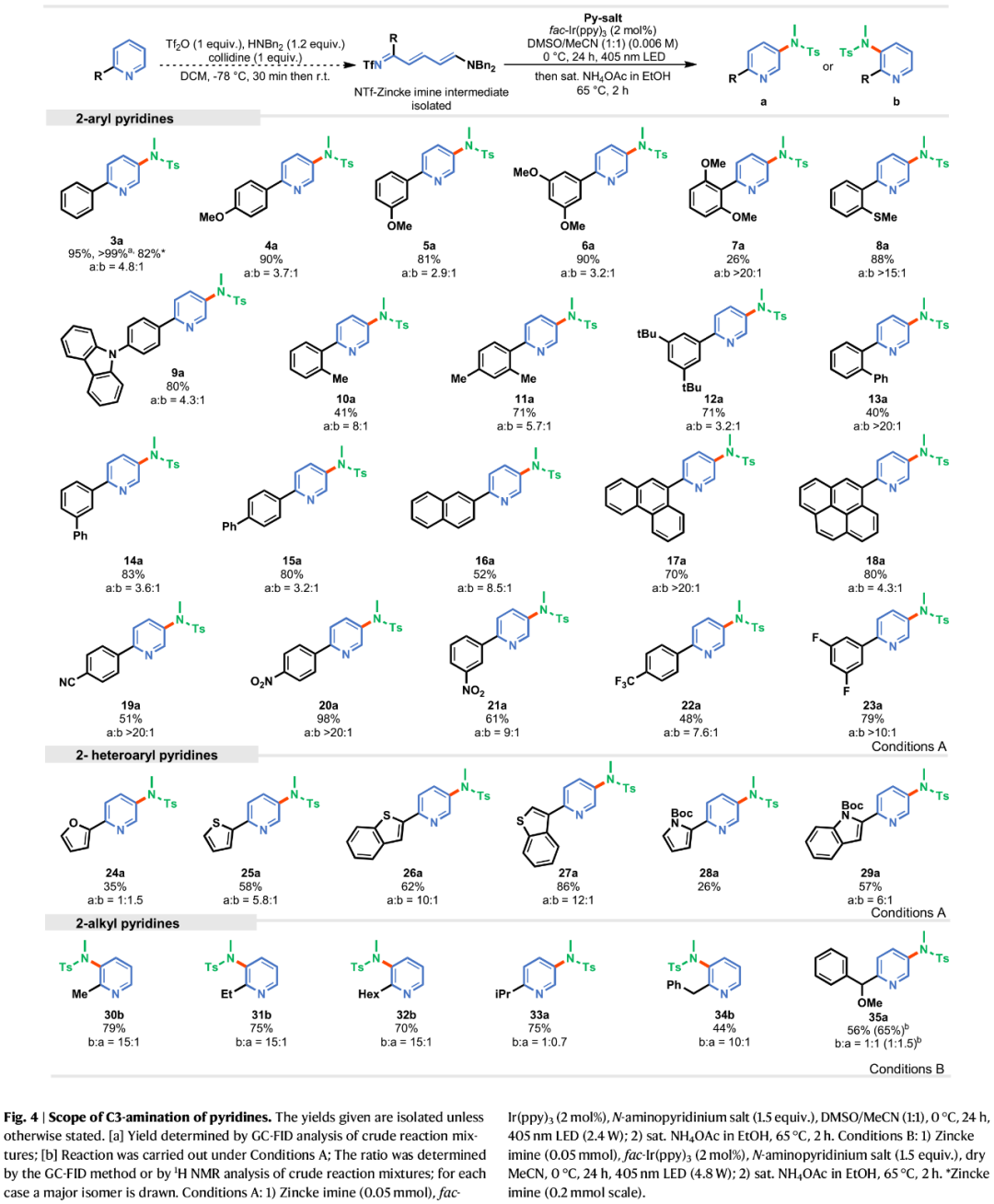
(Figure 4,图片来源:Nat. Commun.)
为了进一步证明合成效用,作者开发了一锅法胺化反应,涉及三级连续反应步骤(Fig. 5)。研究结果表明,该一锅法反应具有出色的兼容性,可以三步55%的总收率得到产物3a,且区域选择性没有降低。
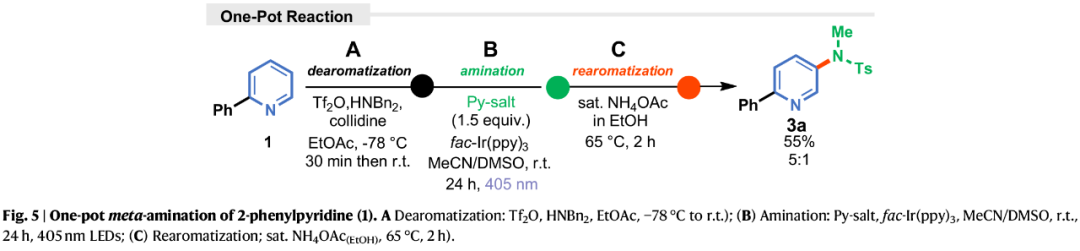
(Figure 5,图片来源:Nat. Commun.)
紧接着,作者对反应的机理进行了研究(Fig. 6)。TEMPO捕获实验结果表明,反应涉及自由基的机理(Fig. 6A)。向反应体系中加入自由基自旋捕捉剂DMPO后,其与N-氨基吡啶盐产生的自由基形成加合物(Fig. 6B)。动力学实验表明,酰胺化Zincke亚胺2a在12小时内逐渐形成(Fig. 6C)。由于其不稳定性,分离的产率仅为15%,但可通过核磁共振波谱和X-射线晶体学确认其结构(Fig. 6D)。
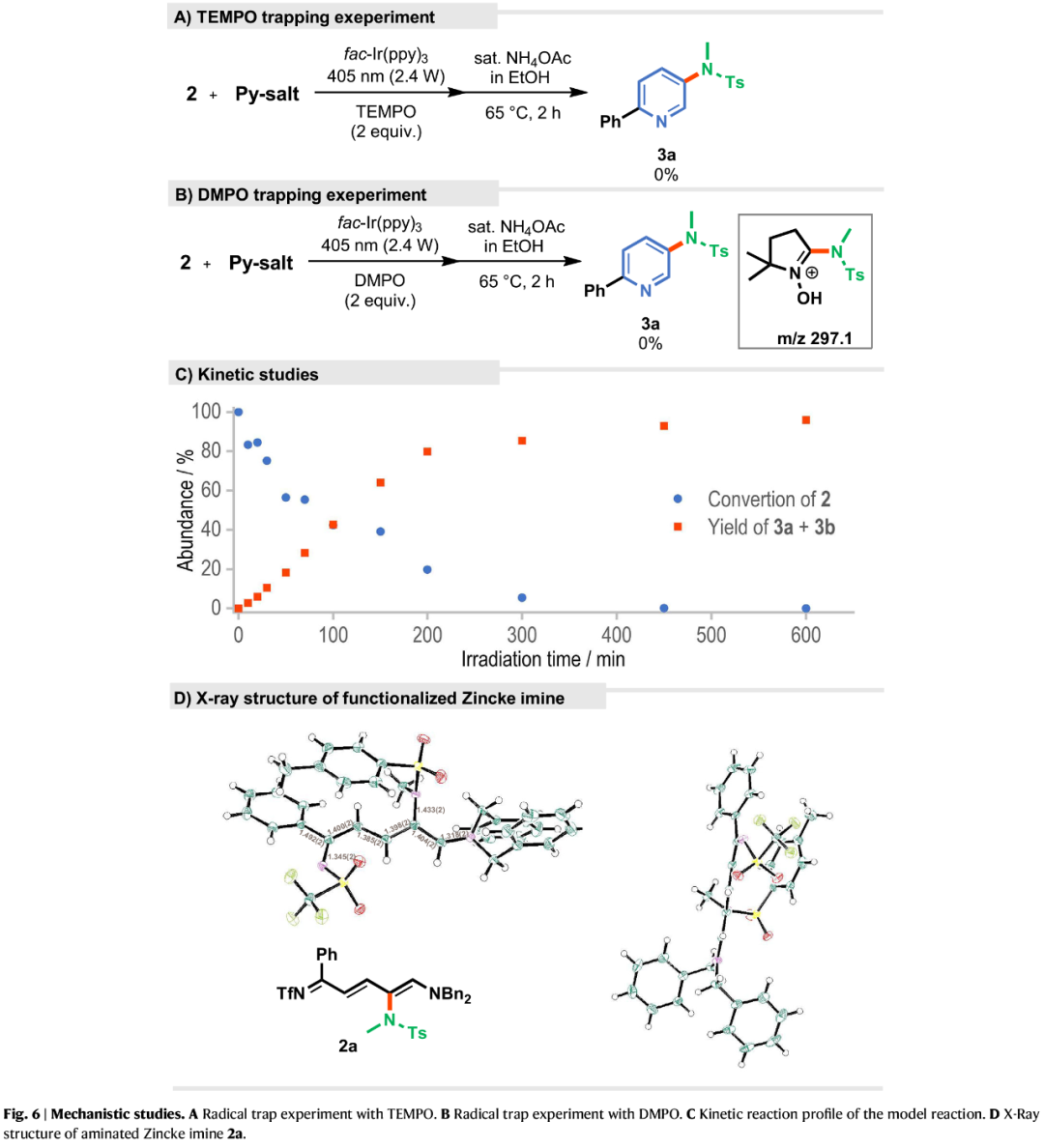
(Figure 6,图片来源:Nat. Commun.)
基于上述的实验、相关理论计算的研究以及相关文献的查阅,作者提出了一种合理的反应机理(Fig. 7)。首先,在光诱导条件下,N-氨基吡啶盐通过激发态[Ir(III)]光氧化还原催化剂的单电子转移(SET)生成自由基A。其次,自由基A经断裂反应,经低能垒过渡态(TS-1),生成氮中心自由基B,同时生成三甲基吡啶副产物。自由基B在δ-位与Zincke亚胺衍生物反应,形成C-N键和相应的中间体C。随后,中间体C被Ir-(IV)催化剂氧化,生成阳离子衍生物D,同时再生Ir-(III)催化剂的基态。最后,用三甲基吡啶对阳离子D进行脱质子化,从而获得目标产物E。此外,从产物E到最终产物3a的环化反应,涉及脱保护/闭环的串联过程。
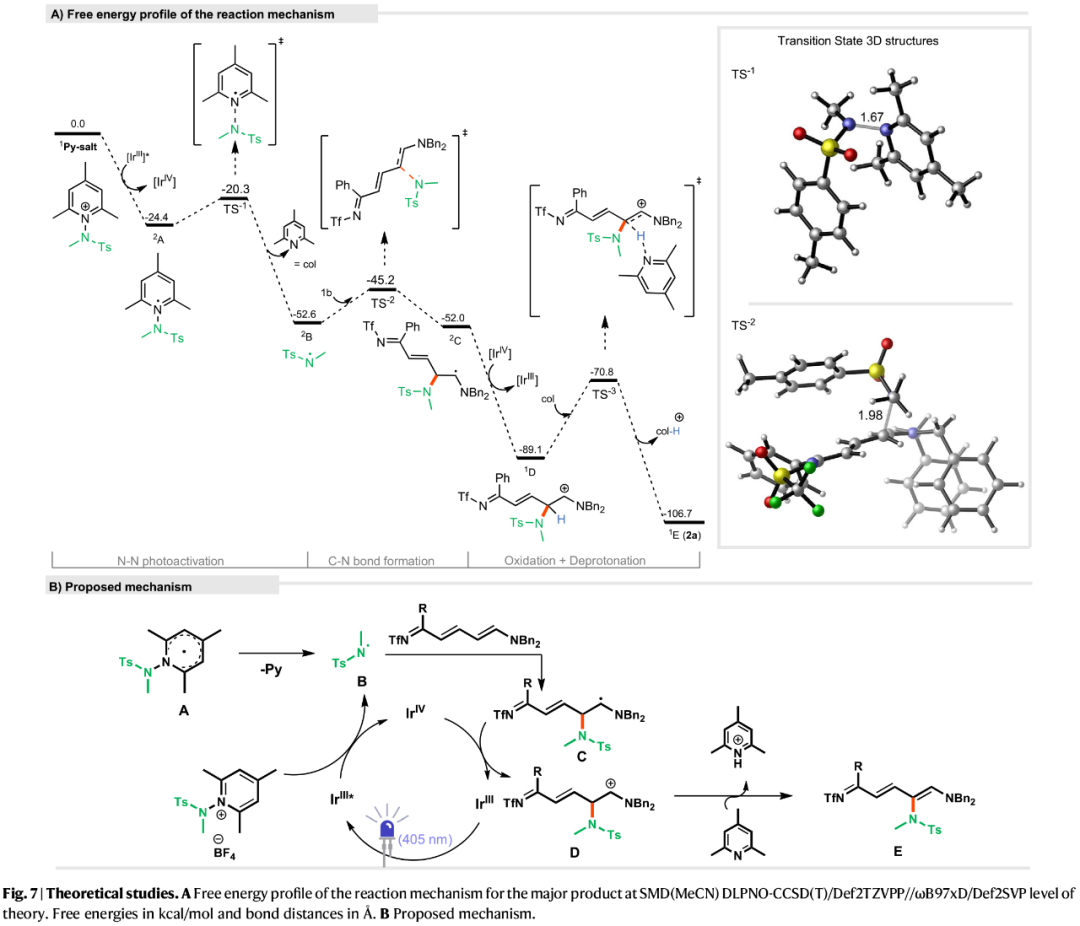
(Figure 7,图片来源:Nat. Commun.)
最后,作者对反应的实用性进行了研究提出了一种合理的反应机理(Fig. 8)。首先,3a与3b通过脱保护,可获得含有游离NH基团的化合物36和37。同时,37可与酰氯衍生物继续进行酰化反应,可以80%的收率得到酰胺化合物38。其次,在mCPBA存在下,3a可进一步转化为吡啶N-氧化物(39)。在MeI存在下,3a可进一步转化为N-甲基吡啶鎓衍生物(40)。此外,用2-苯基Zincke亚胺2还可经多步串联反应,实现C3-和C5-位双官能团化反应,如41a。
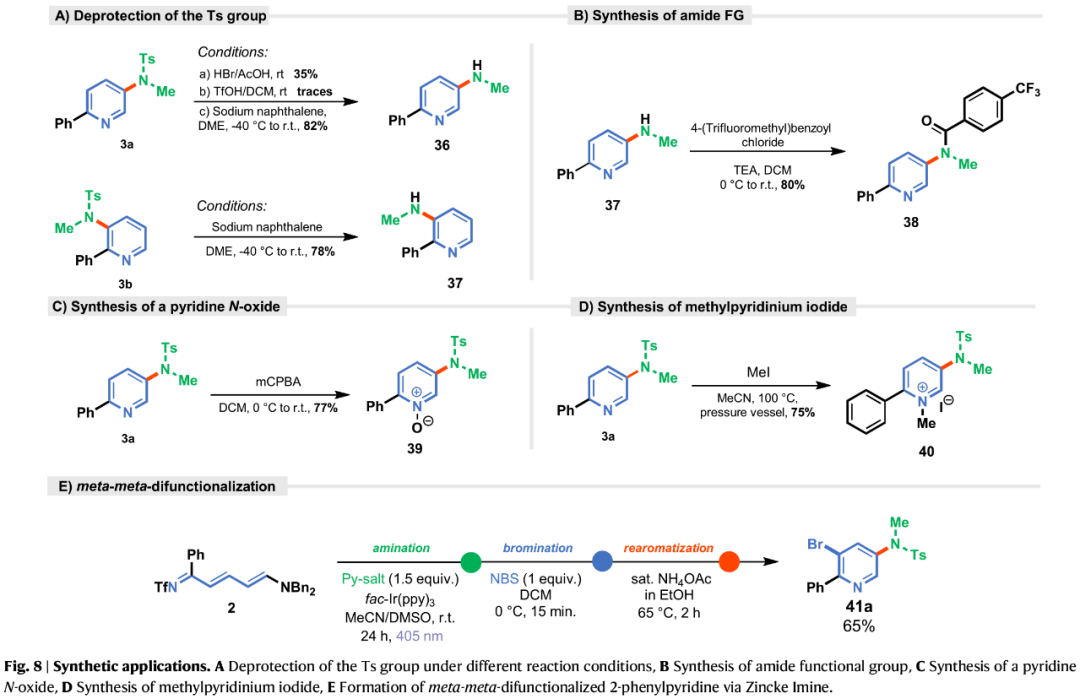
(Figure 8,图片来源:Nat. Commun.)
波兰科学院有机化学研究所Dorota Gryko与西班牙拉里奥哈大学Ignacio Funes Ardoiz团队基于去芳构化/再芳构化策略,实现了吡啶的外围位点编辑。吡啶经活化形成Zincke亚胺中间体后,与光化学产生的亲电性氮中心自由基(源自N-氨基吡啶盐)发生反应,经芳构化后,从而获得目标产物。其中,C-N键主要于C3-位形成。其次,根据底物C2-位取代基的性质(芳基/烷基),可分别获得C3-/C5-位或C2-/C3-位官能团化的吡啶衍生物。此外,DFT计算证实自由基优先进攻δ-位,反应机理由以下反应步骤组成:铱催化剂介导还原N-氨基吡啶盐生成氮中心自由基、氮自由基选择性加成以及自由基中间体的氧化/去质子化等过程。




