河北大学王力竞/李玮OL:光催化N-高烯丙基醛腙的氟磺酰化/氟磺酰胺化反应—制备FSO₂-/FSO₂N-功能化四氢哒嗪类化合物
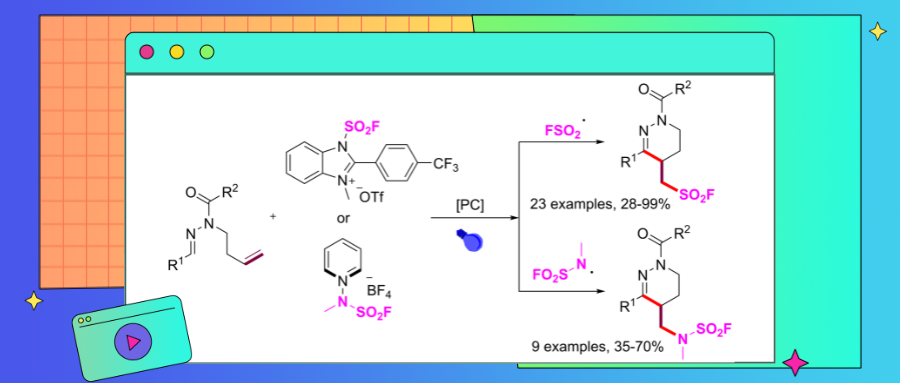
磺酰氟和胺基磺酰氟是化学和药物科学中的关键结构单元。自从2014年Sharpless将硫(VI)氟化物交换(SuFEx)确定为新一代的点击化学反应后,对磺酰氟化合物和相关化合物的研究显著激增,许多合成方法被开发出来。特别是有关杂环磺酰氟的合成研究受到了广泛关注。然而,目前针对具有杂环骨架的胺基磺酰氟的直接合成方法,目前仍不够成熟和完善。近日,河北大学王力竞和李玮课题组在前期发展的合成磺酰氟类化合物的系列工作基础上(Org. Lett. 2023, 25, 3910-3915;Org. Lett. 2023, 25, 7051-7056;J. Org. Chem. 2024, 89, 13847-13852;Adv. Synth. Catal. 2025, 367, e202401539; Org. Lett. 2025, 27, 1656-1661),提出了一种利用FABI(1-氟磺酰基-2-芳基苯并咪唑鎓三氟甲磺酸盐)和NFSAP(N-氟磺酰氨基吡啶鎓盐)分别为磺酰氟和胺基磺酰氟试剂,在光催化策略下实现了N-高烯丙基醛腙的氟磺酰化/氟磺酰氨化反应,高效的构建了一系列氟磺酰基/氟磺酰胺基取代的四氢哒嗪类化合物。该方法显示出良好的合成可扩展性,能够进行多种衍生化反应—包括SuFEx点击反应和消除反应。初步的机理研究表明,该转化是通过氟磺酰基/氟磺酰胺基自由基诱导的串联环化反应进行的。
(来源:Org. Lett.)
硫(VI)氟化物交换(SuFEx)点击化学已成为有机合成、药物发现及材料科学领域的关键技术方法。其中,磺酰氟化合物与胺基磺酰氟化物凭借卓越的化学稳定性和以硫为中心的化学选择性,逐渐成为该方法中不可或缺的核心结构单元。值得关注的是,将这类基团引入已知生物活性分子后,往往能显著提升其药理学特性,甚至赋予其全新的药理活性。近年来,科研人员开发了大量创新性合成策略,用于构建含 FSO₂-和 FSO₂N-取代基的化合物,极大地丰富了这类多功能官能团的合成工具箱。其中,具有杂环结构的磺酰氟 / 氨磺酰氟化合物的合成受到了日益广泛的关注 —— 这主要源于杂环化合物在天然产物及功能有机分子中占据的关键地位。合成上述磺酰氟化合物的典型方案主要包含三种模块化合成途径:(1)不饱和磺酰氟试剂的环加成反应(图 1a);(2)基于不饱和磺酰氟试剂的 Michael 加成策略(图 1b);(3)通过过渡金属催化或自由基诱导途径实现的串联反应策略(图 1c)。
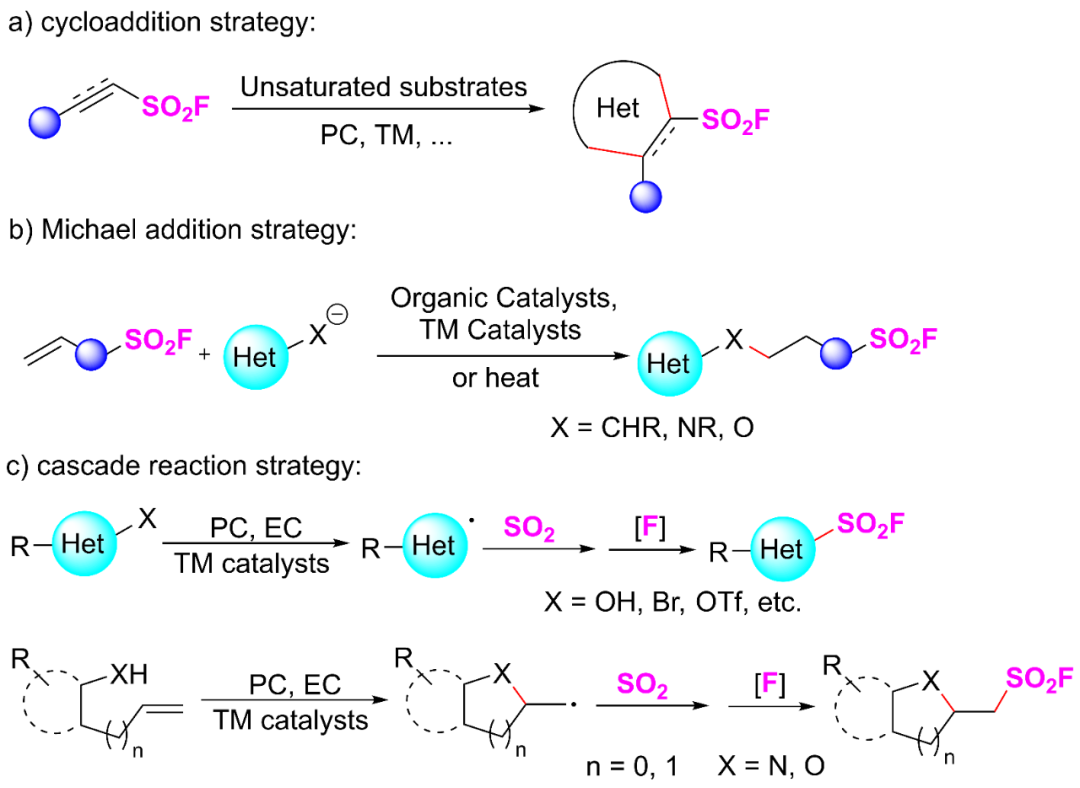
图1 杂环磺酰氟的合成策略。(来源:Org. Lett.)
然而,这些策略大多聚焦于杂环磺酰氟的制备,而针对具有杂环骨架的胺基磺酰氟的直接合成方法,目前仍不够成熟和完善。近年来,光催化策略的持续发展与新型磺酰氟 / 氨磺酰氟试剂的设计创新逐渐融合,形成了一种变革性策略 —即通过氟磺酰基 / 氟磺酰氨基自由基介导的烯烃串联环化反应,实现杂环磺酰氟 / 胺磺酰氟的模块化合成。2022年,廖赛虎课题组公开了一种氟磺酰基自由基介导的串联反应,使用FABI成功构建一系列磺酰氟取代的苯并二氢吡喃,随后廖赛虎课题组和黄申林课题组扩展了这一策略,获得了FSO2-官能化的γ-内酯和苯并稠合杂环化合物(图2a)。2024年,三个独立的研究小组(廖赛虎课题组、翁江课题组和王毅课题组)报告了N-氟磺酰氨基吡啶鎓盐(NFSAP)的开发。其类似于FABI试剂,在光催化条件下产生氟磺酰胺基自由基并与烯烃底物有效地进行串联环化,以合成氟磺酰氨取代的苯并杂环和γ-内酯(图2b)。
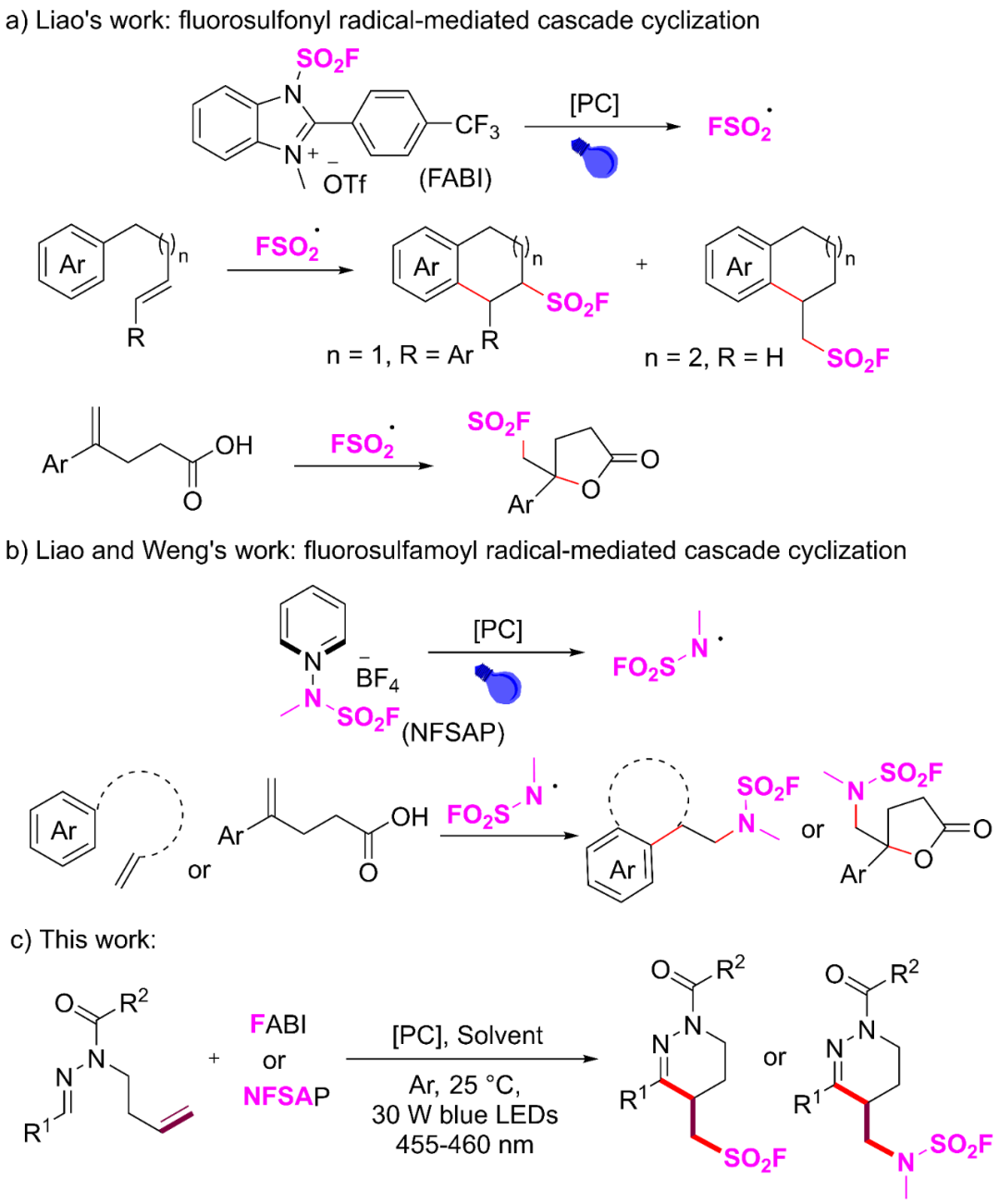
图2 氟磺酰基/氟磺酰氨基自由基介导的烯烃串联环化反应。(来源:Org. Lett.)
尽管已经取得了上述研究进展,但现有的方案依赖于使用芳环或氧原子捕获由氟磺酰/氟磺酰氨自由基加成到不饱和键后所产生的碳自由基,而这些碳自由基在碳-氮键上的类似捕获反应仍未得到探索。
四氢哒嗪骨架作为一类特殊的含氮杂环,在天然产物及药理学研究中广泛存在,同时在复杂结构合成中也扮演着多功能中间体的角色。因此,对构建这一高价值杂环单元的高效策略的探索,极大地推动了创新合成方法的发展。近期,N - 高烯丙基醛腙的光催化自由基级联环化策略,为四氢哒嗪衍生物的制备提供了一种颇具吸引力的途径。然而,将氟磺酰基或氟磺酰氨基引入这一独特杂环骨架的方法仍有待开发。鉴于氟磺酰基 / 氟磺酰氨基官能化四氢哒嗪的潜在应用价值,以及团队对磺酰氟化学的持续关注,该文报道了一种温和高效的光催化策略,用于实现 N - 高烯丙基醛腙的氟磺酰化 / 氟磺酰氨基化反应。该方法可直接构建多种具有广泛官能团耐受性的氟磺酰基 / 氟磺酰氨基取代的四氢哒嗪衍生物(图2c)。
通过条件筛选发现的最优反应条件为: 苯甲醛N-高烯丙腙1a (0.2 mmol), Na2CO3 (1.2 equiv), FABI (3.0 equiv)和 fac-Ir(ppy)3 (2 mol%),在CHCl3 (4 mL),氩气氛围,25℃及30 W blue LED光照反应条件下反应12 h,能以84%的收率得到氟磺酰化产物2a。在此条件下,作者对底物普适性进行了考察(图3)。该反应的适用性良好,具体情况如下:
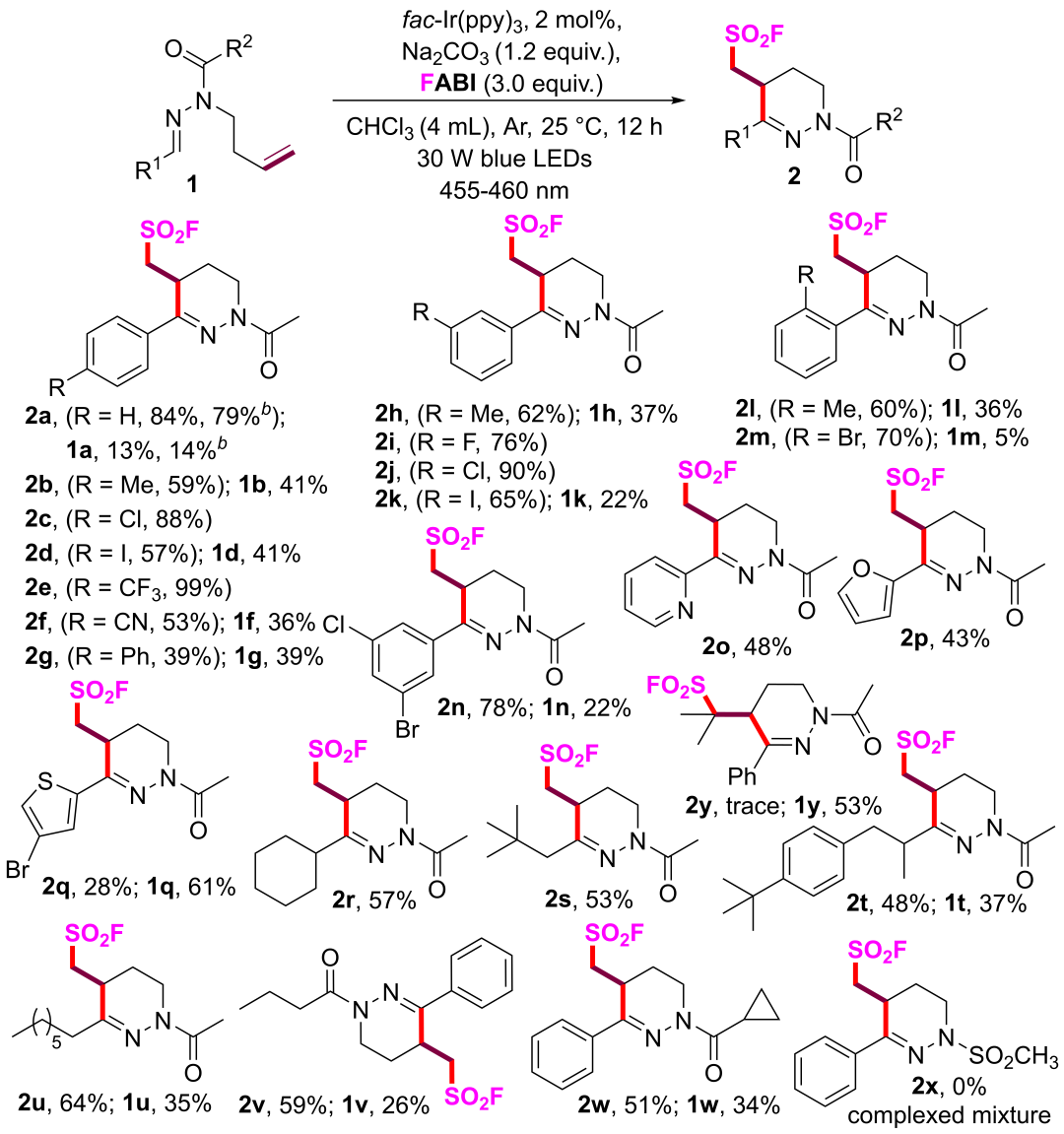
图3 光催化氟磺酰自由基介导的N-高烯丙基醛腙串联环化反应的适用范围(来源:Org. Lett.)
课题组随后使用NFSAP探索了类似的反应,经过优化后该反应同样具有良好的合成多样性(图4)。
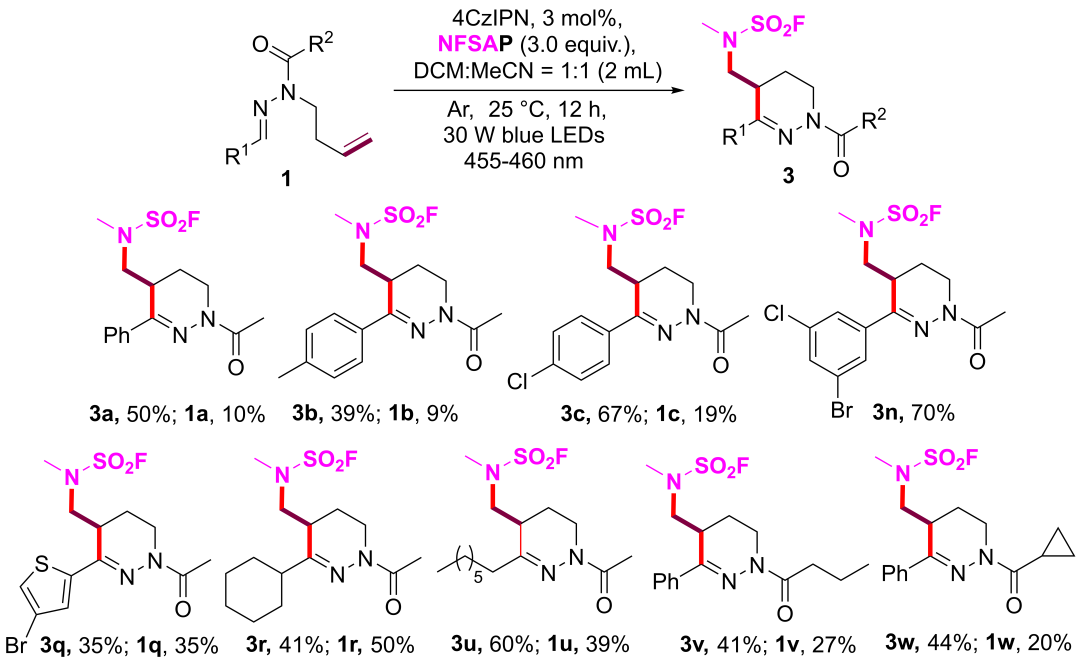
图4 光催化氟磺酰氨基自由基介导的N-高烯丙基醛腙串联环化反应的适用范围。(来源:Org. Lett.)
为了进一步探索这些光催化氟磺酰基/氟磺酰胺基自由基介导的串联环化反应的合成效用,团队测试了在2 mmol规模下制备2a的放大反应并以79%的产率得到相应目标产物,随后通过各种SuFEx点击反应对2a进行衍生化。多种氮亲核试剂和氧亲核试剂都能有效反应,以良好的产率提供相应的磺酰氨、磺酰叠氮化物和磺酸酯(图5a)。值得注意的是,当使用甲醇钠作为2a的氧亲核试剂时,预期的取代反应受到抑制。相反,磺酰氟基团的消除占主导地位,以85%的收率产生4-亚甲基四氢哒嗪12。在相同条件下,氟磺氨甲酰基四氢哒嗪3a同样经历了消除,以86%的收率得到相同的消除产物12(图5b)。
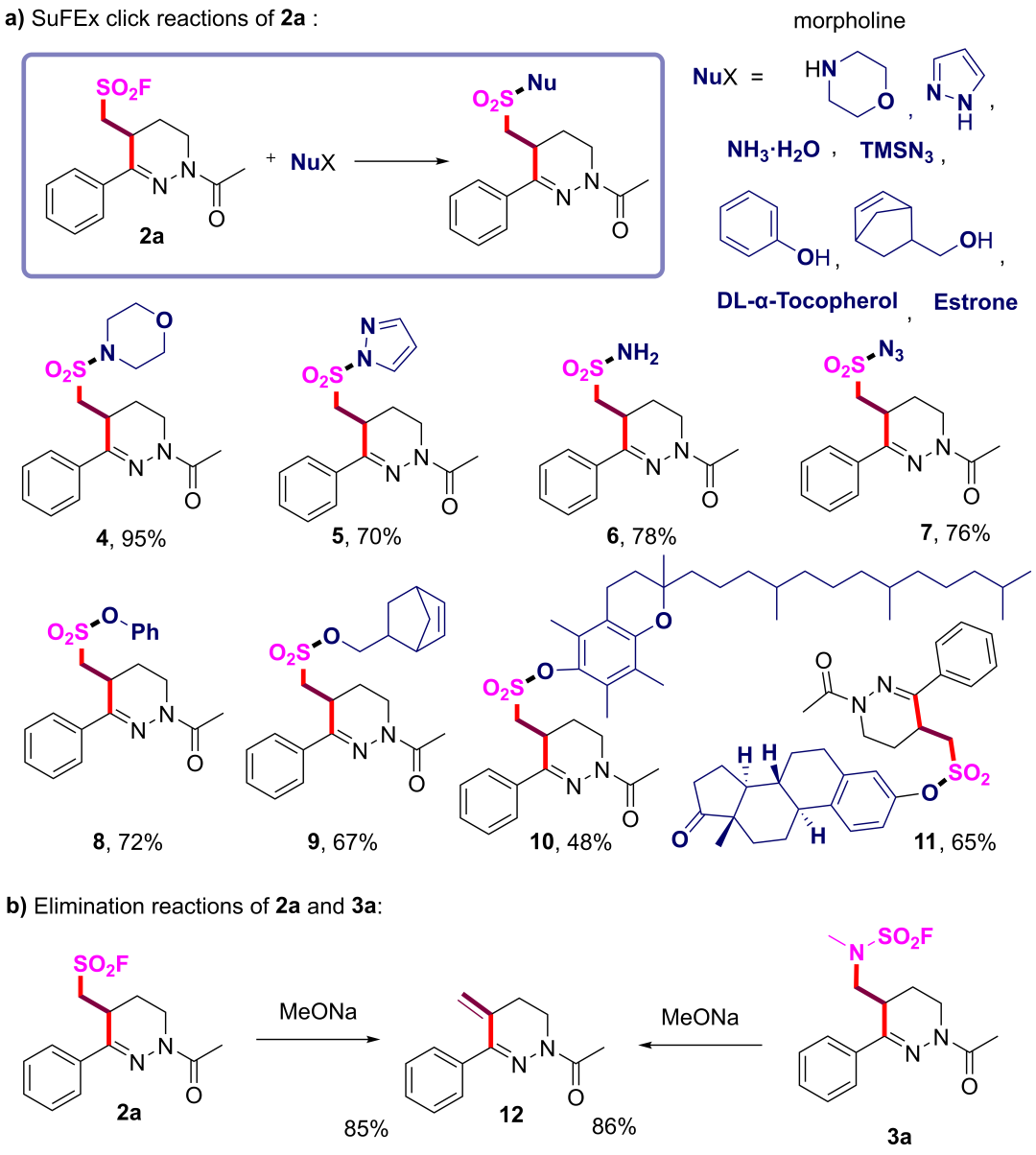
图5 合成应用(a)2a的SuFEx点击反应。(b)2a和3a的消除反应。(来源:Org. Lett.)
根据机理研究和相关文献报道,团队提出了可能的反应机理(图6)。
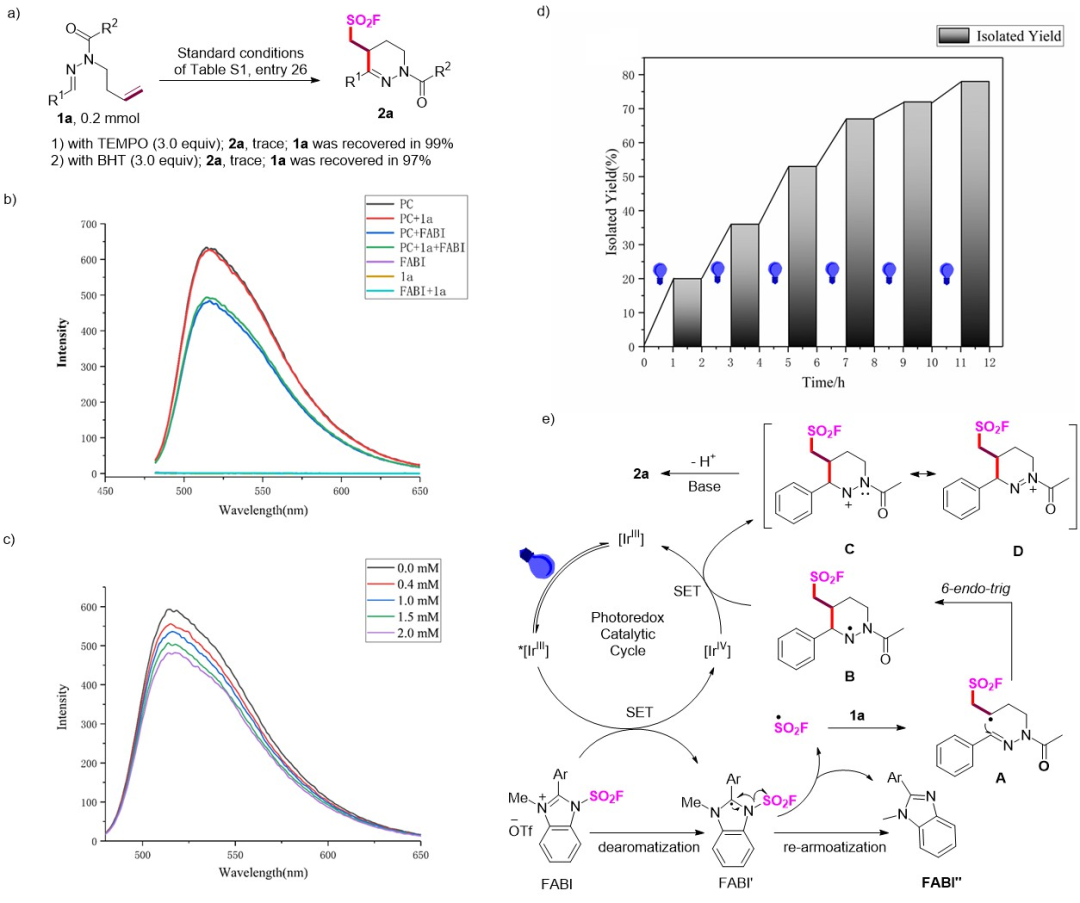
图6 机理探究实验与可能的反应机理(来源:Org. Lett.)
该工作近期发表在 Organic Letters上 (Org. Lett. 2025, DOI: 10.1021/acs.orglett.5c02385),河北大学化学与材料科学学院董熠晨硕士研究生为第一作者,河北大学化学与材料科学学院李玮教授,王力竞副教授为通讯作者。该研究工作得到河北省自然科学基金、河北大学科研创新团队、河北大学化学与材料科学学院、药物化学与分子诊断教育部重点实验室、河北省化学生物学重点实验室的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




